パーキンソン病原因遺伝子の異常による神経活動低下の仕組みを解明
PR TIMES / 2017年5月26日 13時28分
~シナプス小胞の再生経路の操作により神経活動の正常化に成功~
順天堂大学大学院医学研究科・神経学の服部信孝教授、パーキンソン病病態解明研究講座の今居譲先任准教授の研究グループは、2つのパーキンソン病の原因遺伝子Vps35*1とLRRK2*2が、協働してシナプス小胞*3の動態を制御していることを明らかにしました。さらに、シナプス小胞の再生の調節により、神経機能異常の改善が可能なことをパーキンソン病モデル動物で示しました。この成果はパーキンソン病の発病メカニズムの一端を明らかにし、今後のパーキンソン病の予防・治療法の開発に役立つ成果です。
本研究内容は英国科学誌 Human Molecular Geneticsに早期公開版として、2017年5月8日付けで発表されました。
【本研究成果のポイント】
パーキンソン病原因遺伝子Vps35とLRRK2が協働してシナプス機能を調節することを示した
Vps35変異に起因するシナプス異常を抑制する遺伝子としてRab5やRab11を発見
シナプス小胞の再生を促すことでVps35欠失動物のパーキンソン病様の症状が改善される
【背景】
パーキンソン病は、中脳ドーパミン神経*4の変性を特徴とする難治性の神経変性疾患ですが、近年、運動障害をはじめ、睡眠障害、嗅覚障害、自律神経障害など様々な神経症状を呈することが明らかとなってきました。パーキンソン病を頻発する複数の家系から、20以上の原因遺伝子が特定されてきましましたが、それらのほとんどは神経細胞における機能がわかっていません。そのため、原因遺伝子が神経細胞でどのような役割を持つか、その遺伝子に傷が入るとなぜパーキンソン病になるのか、という問題を解明し、この病気の発症原因を理解する必要があります。
細胞内の物質輸送に関わるVps35遺伝子についても、その変異がパーキンソン病の発症原因となります。しかし、Vps35の神経細胞での働き、Vps35の変異による疾患への影響は不明でした。そこで、パーキンソン病原因遺伝子の機能の解明に強力なモデル動物であるショウジョウバエを用いて、Vps35の神経細胞での機能、変異体の神経活動への影響を調べました。
【内容】
Vps35は非神経細胞において物質輸送に関与していることがわかっています。その働きは生存に必須なため、Vps35を欠失したハエは成長途中(蛹になる前)で死亡します。今回、私たち研究グループは、Vps35欠失ハエにパーキンソン病家系で見つかったVps35の変異体を再導入することで、正常なハエと同様に生存可能になることを確認しました。このことは、Vps35の変異体は非神経細胞では生死に影響なく働くことを意味しています。一方、神経細胞ではVps35の変異体の導入によって、異常な神経活動が生じました(図1)。
[画像1: https://prtimes.jp/i/21495/22/resize/d21495-22-166603-4.jpg ]
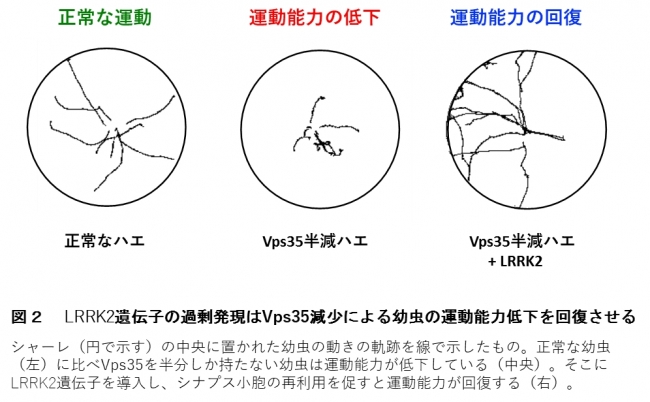
また、Vps35のタンパク質量を半減しただけでも神経活動に異常が生じ、睡眠や運動機能にも障害がでました(図2) 。
[画像2: https://prtimes.jp/i/21495/22/resize/d21495-22-933923-3.jpg ]
さらに詳細に観察すると、神経細胞間の情報をやりとりするシナプス小胞の再利用メカニズムに異常が生じていることが明らかになりました(図3) 。
[画像3: https://prtimes.jp/i/21495/22/resize/d21495-22-728736-9.jpg ]
これらの結果から、パーキンソン病変異型のVps35は、神経細胞においてシナプス小胞の再生を障害し、神経活動を低下させると考えられます。
Vps35の欠失によるシナプス小胞の異常は、別のパーキンソン病の原因遺伝子LRRK2を欠失したハエのシナプス小胞の異常と酷似していました。これを手掛かりにVps35が半減したハエにLRRK2遺伝子を導入すると、Vps35半減ハエの神経活動や睡眠・運動機能の障害が改善しました(図2)。2015年、私たち研究グループは小胞輸送で働くGTPase*5 であるRab5、Rab11とLRRK2とが一緒に働くことを見つけていましたが*6、今回、Rab5、Rab11の発現量を調節すると、シナプス小胞の再生が促され、Vps35半減による神経活動異常や睡眠・運動機能の障害から回復することを確認しました。
本研究により、Vps35やLRRK2が神経の情報伝達の場であるシナプスで、シナプス小胞の再生効率を調節する機能を担っていることを明らかにしました。さらにシナプス小胞の再生機構の回復により、Vps35やLRRK2の変異による神経活動低下の改善が可能であることを示しました(図4)。
[画像4: https://prtimes.jp/i/21495/22/resize/d21495-22-136463-8.jpg ]
これは、神経シナプス機能を適切に調節することがパーキンソン病治療に有効であることを意味します。
【今後の展開】
パーキンソン病原因遺伝子には、Vps35、LRRK2以外にも複数の細胞内物質輸送に関わる遺伝子があり、それらもシナプス機能制御に関わっている可能性があります。本研究において、シナプス機能の正常化がパーキンソン病モデル動物の神経機能回復に有効であったように、他の原因遺伝子の変異に起因するパーキンソン病においても、シナプス機能の正常化を目的とした治療法が効果的だと考えています。ただ、シナプス機能制御メカニズムは複雑で、たくさんの遺伝子産物が相互に作用しあうネットワークを作っていると考えられます。今後は、そうしたネットワークの中から最も重要な遺伝子を特定することで、より効果的な治療法の開発につなげていきたいと考えています。
【用語解説】
*1 Vps35(Vacuolar protein sorting-associated protein 35 ):Vps35遺伝子は、優性遺伝性パーキンソン病の原因遺伝子の一つである。 Vps35遺伝子から作られるタンパク質は、同名のVps35と名付けられている。ここでは便宜上、遺伝子は「Vps35遺伝子」、タンパク質は「Vps35」と表記する。Vps35は細胞内での物質の輸送に関わるが、Vps35の働きの減少はアルツハイマー病のリスクになるとの報告もある。
*2 LRRK2 (Leucine-rich repeat kinase 2):LRRK2遺伝子は、優性遺伝性パーキンソン病の原因遺伝子の一つである。LRRK2遺伝子から作られるタンパク質は、同名のLRRK2と名付けられている。ショウジョウバエではLRRK遺伝子と呼ばれているが、LRRK2遺伝子と同様の機能を持つと考えられていることから、「LRRK2遺伝子」と表記している。タンパク質リン酸化酵素で、細胞内での物質の輸送に関わる。
*3 シナプス小胞:神経伝達物質を格納する脂質膜で覆われた袋状の構造。神経活動に応じて、格納された神経伝達物質は外に放出され、袋を形成していた脂質膜は、細胞膜と融合する。細胞膜から脂質膜を回収して、再びシナプス小胞を作ることをシナプス小胞の再生という。
*4 中脳ドーパミン神経:パーキンソン病において神経変性が起こる神経。この神経が変性するとパーキンソン病で見られる運動機能障害(手足の震え、筋肉の硬直、姿勢制御の障害など)が起こる。
*5 GTPase:グアノシン三リン酸(GTP)を加水分解する酵素群で、細胞内の多様なシグナル伝達に関与する。
*6 「晩発性パーキンソン病で神経変性がゆっくり進行するメカニズムを解明 ~細胞内輸送におけるLRRK2の役割~」にて2015年9月8日 順天堂大学よりプレス発表。
発表誌:Human Molecular Genetics
タイトル:Vps35 in cooperation with LRRK2 regulates neuronal synaptic functions through the endosomal pathway in Drosophila
日本語訳:Vps35とLRRK2はショウジョウバエにおいて、エンドサイトーシス経路を介してシナプス機能を制御する
著者名:Tsuyoshi Inoshita, Taku Arano, Yuka Hosaka, Hongrui Meng, Yujiro Umezaki, Sakiko Kosugi, Takako Morimoto, Masato Koike, Hui-Yun Chang, Yuzuru Imai, Nobutaka Hattori
DOI:10.1093/hmg/ddx179
謝辞:なお、本研究はJSPS科研費 JP16K09679、JP26860219、JP26293070、JP15H04842、MEXT科研費 JP23111003、および大塚製薬の研究助成を受け、東京薬科大学 森本高子先生、本学医学研究科 神経機能構造学講座 小池正人先生、台湾国立清華大 Dr. Hui-Yun Changらとの共同研究として行われました。
企業プレスリリース詳細へ
PR TIMESトップへ
この記事に関連するニュース
-
薬物による副作用が皮膚で起こりやすい原因を発見~ヒト白血球抗原を介した細胞内からのストレスが引き金~
PR TIMES / 2024年4月15日 15時45分
-
名大、飲酒による二日酔いの原因物質が遺伝子を傷つけ老化を引き起こすと発表
マイナビニュース / 2024年4月12日 17時55分
-
光で記憶を操る!新たな技術「光駆動型ホスホリパーゼCβ」を開発
Digital PR Platform / 2024年4月6日 9時1分
-
生きた細胞内で小胞の動きを可視化し、2種類の小胞融合機構を発見
Digital PR Platform / 2024年4月5日 14時0分
-
治療用ヘッドセットも実用化間近...「40ヘルツの光や音」がアルツハイマー病の進行を遅らせる可能性と、そのメカニズム
ニューズウィーク日本版 / 2024年4月1日 21時50分
ランキング
-
1グリコ「チルド食品」出荷再開→再停止…システム障害で 乳製品・洋生菓子など、5月中旬の再開目指す【全文】
ORICON NEWS / 2024年4月19日 18時57分
-
2日本在留の外国人が日本で働きたくない理由 2位は「働く環境が悪い」、1位は?
ITmedia ビジネスオンライン / 2024年4月19日 17時15分
-
3東証、一時1300円安 大幅反落、2カ月ぶり安値水準
共同通信 / 2024年4月19日 12時5分
-
4東証大幅反落、終値1011円安 中東緊迫、3年2カ月ぶり下げ幅
共同通信 / 2024年4月19日 17時36分
-
5格安スマホの利用者は約4割 実際に支払っている月額利用料金の2位は「2000円台」、1位は?
ITmedia ビジネスオンライン / 2024年4月19日 17時15分
記事ミッション中・・・
記事にリアクションする
![]()
記事ミッション中・・・
記事にリアクションする

エラーが発生しました
ページを再読み込みして
ください










