脳梗塞急性期治療で生じる再灌流障害の画期的な予防法の開発
PR TIMES / 2019年10月5日 4時35分
~新規酸化ストレス応答性アポトーシス誘導因子ORAIPに対する抗体療法~
順天堂大学大学院医学研究科乳酸菌生体機能研究講座の世古義規客員教授、奥村康特任教授、研究基盤センター生体分子研究室の藤村務客員准教授、村山季美枝客員准教授と、 横浜市立大学大学院医学研究科 脳神経外科学教室の岸本真雄(大学院生)、末永 潤講師、山本哲哉教授らの研究グループは、 脳梗塞急性期の治療時に引き起こされる再灌流障害*1を予防する画期的な治療法を開発しました。
神経細胞のアポトーシス(細胞死)*2は虚血再灌流などの酸化ストレス時に誘導されることが知られており、従来は活性酸素により引き起こされると考えられていましたが、本研究により、研究グループが発見した酸化ストレス応答性アポトーシス誘導蛋白(ORAIP)が主たる原因となることが明らかになりました。今回、急性期脳梗塞のモデルを用いてORAIPに対する中和抗体を投与することにより、従来の治療法を大きく上回る抑制効果が認められました。また、虚血が起こった後、再灌流開始と同時に中和抗体を投与しても同様の効果が得られたことから、脳梗塞を発症して病院に到着後でも十分な効果が期待されます。本研究は、Nature系列の英科学雑誌「Scientific Reports」の電子版(2019年9月18日付)に公開されました。
【本研究成果のポイント】
虚血再灌流障害には活性酸素の関与が考えられてきたが、研究グループが発見した酸化ストレス応答性アポトーシス誘導蛋白(ORAIP)が大きな役割を果たしていることが明らかになった。
急性期脳梗塞に対する再灌流療法時に生じる細胞障害を大きく改善する治療法を開発した。
本治療法は脳梗塞以外にも、有効な治療法のない広範な疾患に対して新たな効果が期待される。
【背景】
外界からの生体への細胞障害の多くは虚血再灌流障害をはじめとする酸化ストレスによって起こり、動脈硬化・成人病・癌などの原因になっていると考えられていますが、その機序は不明でした。研究チームは低酸素負荷後再酸素化刺激をした細胞から(翻訳後修飾を受けた)eIF5A*3 が分泌され、細胞のアポトーシスを誘導していることを明らかにし、この新規アポトーシス誘導因子(分泌型eIF5A)をOxidative-stress Responsive Apoptosis-Inducing Protein (ORAIP)と命名しました (Sci Rep 2015;5:13737; doi: 10.1038/srep13737)。これまでの研究によりORAIPは生体の酸化ストレス応答全般に共通の因子である可能性が高く、従来考えられてきた活性酸素より大きな役割を果たしていることが分かってきたことから、酸化ストレスによる細胞障害の診断・治療のきわめて有望な標的となると考えられます。
【内容】
最初に脳虚血再灌流による神経細胞のアポトーシスが主としてORAIPによって媒介されているか否かを培養細胞を用いた実験で検討しました。ラットの培養神経細胞に低酸素再酸素化刺激を行うと細胞上にORAIPの明らかな発現が見られ、神経細胞のアポトーシスが誘導されました。ORAIP の中和抗体は、この低酸素再酸素化刺激によるアポトーシスを有意に抑制しました。また、ORAIPを培養神経細胞に投与すると神経細胞のアポトーシスが誘導されたことから、神経細胞のアポトーシス誘導にORAIPの関与が大きいことが示されました。 次に脳虚血再灌流の動物モデルでORAIPの役割を確認するため、安定した脳虚血領域が得られることが知られている自然発症高血圧ラットを用いて中大脳動脈・総頚動脈の同時遮断による脳虚血再灌流実験を行いました。脳虚血再灌流後、髄液中のORAIP濃度は再灌流30分後をピークとして有意の上昇を認めました。
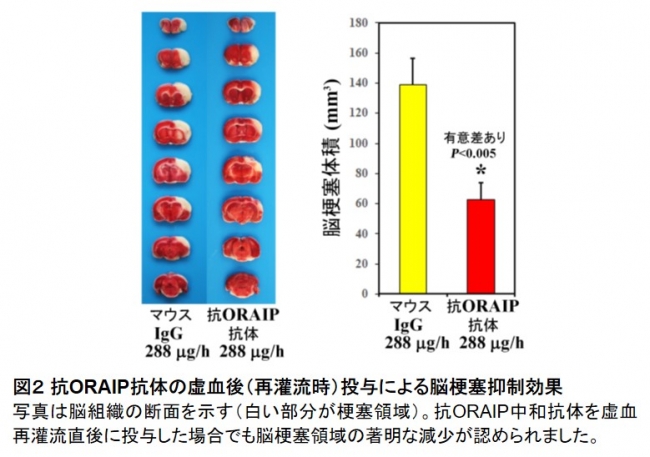
そこで虚血48時間前から、脳室内に持続ポンプを留置して抗ORAIP中和抗体を投与すると、用量依存的に脳梗塞(虚血再灌流障害)領域の著明な減少を確認しました(6 µg/hで73時間投与、コントロール群より約72%の減少。図1)。さらに、抗ORAIP中和抗体を虚血再灌流直後に投与した場合でも脳梗塞領域の著明な減少が認められました(288 µg/hで30分間投与、コントロール群より約55%の減少。図2)。
[画像1: https://prtimes.jp/i/21495/133/resize/d21495-133-364503-1.jpg ]
[画像2: https://prtimes.jp/i/21495/133/resize/d21495-133-537661-0.jpg ]
つまり臨床では不可能な虚血前からの投与ではなく、脳梗塞発症後の虚血後からでも抗ORAIP中和抗体を投与することで脳梗塞体積を著明に減少することができました。今回の研究により、従来考えられてきた活性酸素ではなくORAIPが酸化ストレスによるアポトーシス誘導に重要な働きをしていることが確認されました。抗ORAIP抗体が今後製薬化、臨床治験が行われ、実臨床で使用されることで、脳梗塞患者さんの予後改善に多大に寄与する可能性が示唆されました。
【今後の展開】
本研究では、 虚血再灌流以外にも紫外線・放射線照射、抗癌剤投与等の様々な酸化ストレスや、糖尿病、慢性腎臓病、脂質異常、網膜症、心不全等の病態においてもORAIPの血中濃度が有意に上昇することなどが分かっており、ORAIPは生体の酸化ストレス応答に共通の根源的なメカニズムを媒介している可能性が考えられます。すでに、研究グループは細胞膜上のORAIP受容体も同定し、抗体医薬だけでなくデコイ受容体*4や低分子化合物による創薬も期待されます。今後、抗ORAIP抗体のヒト化に続いて、最初の治療対象として今回著効が認められた急性期脳梗塞をはじめ、網膜症、放射線や抗癌剤の副作用抑制、そして糖尿病など広く慢性疾患の臓器障害抑制への臨床応用が考えられます。また、酸化ストレス状態(虚血再灌流や放射線被曝状態等)の非侵襲的な診断法として応用するのみならず、成人病のコントロールの指標としての可能性も検討します。ORAIPは真核細胞*5で構造が保存され酸化ストレス・老化等の生命現象に本質的な役割を果たすと考えられることから、動脈硬化や老化への役割を解析することにより抗動脈硬化・抗老化に向けての可能性を探ります。
【用語解説】
*1 再灌流障害: 脳梗塞や心筋梗塞などの急性期の治療において、血流が止まり酸素が不足していた患部組織に血流を再開させると、酸素の供給が酸化ストレスとなって引き起こされる細胞死による障害。
*2 アポトーシス: プログラムされた細胞死。細胞内にアポトーシスを誘導するシグナル経路の活性化が起こることによって引き起こされ、カスパーゼという一連の酵素が重要な役割を果たす。
*3 eIF5A: 真核細胞翻訳開始因子5A。細胞質内で2段階の酵素反応により(哺乳類では)50番目のリジン残基が修飾アミノ酸であるhypusine化した活性型とdeoxyhypusine化した中間型、および修飾されていない不活性型の形で存在している。蛋白合成に関与しているとされているが、それ以外に何らかの役割があるのではないかと考えられてきた。細胞外に分泌されることはこれまでに報告されていない。
*4 デコイ受容体: ORAIPなどの生理活性物質(リガンド)に結合するがシグナルを伝達しないで阻害する「おとり」となる受容体。
*5 真核細胞: 細胞内に核を有する細胞でほとんどの動物・植物細胞は真核細胞である。
【原著論文】
本研究は、Nature Publishing Groupの電子版雑誌「Scientific Reports」(https:/www.nature.com/srep/)で2019年9月18日に公開されました。
論文タイトル: Oxidative stress-responsive apoptosis inducing protein (ORAIP) plays a critical role in cerebral ischemia/reperfusion injury
日本語訳: 酸化ストレス応答アポトーシス誘導因子ORAIPが脳虚血再灌流障害に決定的な役割を果たす
著者:Masao Kishimoto, Jun Suenaga, Hajime Takase, Kota Araki, Takako Yao, Tsutomu Fujimura, Kimie Murayama, Ko Okumura, Ryu Ueno, Nobuyuki Shimizu, Nobutaka Kawahara, Tetsuya Yamamoto, Yoshinori Seko
著者(日本語表記): 岸本真雄1、末永潤1、高瀬創1、荒木孝太1、八尾貴子2、藤村務3、村山季美枝3 、奥村康4 、上野龍1 、清水信行1 、川原信隆(故人)1 、山本哲哉1、世古義規4
所属:1横浜市立大学大学院医学研究科脳神経外科学、2朝日生命成人病研究所循環器内科、3順天堂大学大学院医学研究科研究基盤センター生体分子研究室、4順天堂大学大学院医学研究科乳酸菌生体機能研究講座
DOI: 10.1038/s41598-019-50073-8
※本研究は、JSPS科学研究費(若手B JP16K20021、基盤研究B JP24390346、JP15H04951)、公益信託美原脳血管障害研究振興基金 美原賞、等の助成を受け実施されました。
企業プレスリリース詳細へ
PR TIMESトップへ
この記事に関連するニュース
-
株式会社DHQ、国立循環器病研究センターと「タキシフォリンの認知症予防/治療に関する共同研究」の実施検討を開始
PR TIMES / 2024年4月1日 10時15分
-
抗酸化サプリメントTwendee Xは指定難病「全身性強皮症」を安全に治療できる可能性が示されました
PR TIMES / 2024年3月29日 19時40分
-
「残業がしばらく続いた」程度の疲労で活性化…うつ病と深い関係があり"ほぼ100%の人"が持つウイルスの名前
プレジデントオンライン / 2024年3月27日 9時15分
-
なぜ花粉症は「国民病」になったのか…日本人の4割を苦しめる花粉症が1970年代から急増したワケ
プレジデントオンライン / 2024年3月24日 14時15分
-
【岡山理科大学】不安は遺伝子の「オン」「オフ」スイッチにより引き起こされる
@Press / 2024年3月21日 13時20分
ランキング
-
1格安スマホの利用者は約4割 実際に支払っている月額利用料金の2位は「2000円台」、1位は?
ITmedia ビジネスオンライン / 2024年4月19日 17時15分
-
2グリコ「チルド食品」出荷再開→再停止…システム障害で 乳製品・洋生菓子など、5月中旬の再開目指す【全文】
ORICON NEWS / 2024年4月19日 18時57分
-
3築地に国際交流拠点、東京都が三井不・読売連合を選定…30年代前半の開業目指す
読売新聞 / 2024年4月19日 22時30分
-
4セブン―イレブン、おにぎりや弁当の「値引き」タイミングを本部が通知へ…食品ロス削減狙い
読売新聞 / 2024年4月19日 20時31分
-
5日本在留の外国人が日本で働きたくない理由 2位は「働く環境が悪い」、1位は?
ITmedia ビジネスオンライン / 2024年4月19日 17時15分
記事ミッション中・・・
記事にリアクションする
![]()
記事ミッション中・・・
記事にリアクションする

エラーが発生しました
ページを再読み込みして
ください










