ドラッグロス解消へ新薬スピード承認…がんや難病などで新制度導入の方針
読売新聞 / 2024年11月28日 15時0分
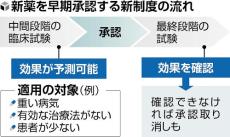
厚生労働省は、がんや難病などの患者に薬を迅速に届けるため、効果が予測できる段階で製造販売を承認する新制度を導入する方針を決めた。承認後に効果が確認できない場合は取り消しを可能とする。欧米で承認された薬が日本で使えない「ドラッグロス」の解消策で、来年の通常国会に医薬品医療機器法の改正案の提出を目指す。
製薬企業が承認を得るためには通常、3段階の臨床試験(治験)を実施し、薬の安全性や効果を確認する。その上で、国に承認申請を行う。
新制度は、命に関わる重い病気や、有効な治療がない、患者が少なく臨床試験に時間がかかるなどのケースが対象となる。中間段階までのデータで効果を予測でき、患者が使う利点が大きいと判断された場合に承認する。安全対策のため、必要に応じて薬を処方できる医療機関や医師の条件を定める。
承認後は原則、最終段階の試験の実施を製薬企業に求める。効果が確認できなかった場合は承認を取り消せる仕組みとする。
米国には、新制度と同様の承認取り消しが可能な迅速承認の仕組みが導入されている。
厚労省は2017年、重い病気の新薬などについて、中間段階までのデータで効果が確認できれば、最終段階の試験を経ずに早期に承認する制度を設けた。
だが、製薬企業にとって条件のハードルはなお高い。これまでの適用は、がんや難病の治療で使われる5品目に限られており、厚労省は、新たな制度の導入が必要と判断した。
ドラッグロスは深刻化している。厚労省によると、欧米で承認済みだが、日本で未開発の薬が23年3月時点で86品目に上る。政府は今年7月に策定した創薬力強化に向けた工程表で、86品目のうち必要性の高い薬について、臨床試験を26年度までに始めるとする目標を盛り込んだ。
新制度が実現すれば、ドラッグロスが生じている薬の開発が日本で進みやすくなるほか、新たなドラッグロスの発生を防ぐ効果も期待される。
この記事に関連するニュース
-
アルツハイマー病の新治療薬「ドナネマブ」の実力と対象者
日刊ゲンダイDIGITAL / 2024年11月6日 9時26分
-
乳がん複数新薬を同時評価 名市大、治験を開始
共同通信 / 2024年11月6日 0時7分
-
がんの自由診療でトラブル続々…原則NGでも、使ってOKの例外あり【中川恵一 がんサバイバーの知恵】
日刊ゲンダイDIGITAL / 2024年11月2日 9時26分
-
「がん免疫療法」うたう自由診療に潜む本当の怖さ 日本人は「あやしい医療」の実態を知らなすぎる
東洋経済オンライン / 2024年11月1日 8時40分
-
米J&Jが新薬で50件承認へ 27年の2桁成長目指す
財界オンライン / 2024年10月30日 18時0分
ランキング
-
1年収1,000万円なんてこんなもん…42歳で部長に抜擢の〈大企業エリート〉。質素すぎる毎日に、部下「夢がない」「このままこの会社にいても」と絶望
THE GOLD ONLINE(ゴールドオンライン) / 2024年11月28日 7時15分
-
2「トイレでスマホ」が招く危険...長時間座りっぱなしの健康リスクとは?
ニューズウィーク日本版 / 2024年11月27日 17時50分
-
3とんでもない通帳残高に妻、絶句。家族のために生きてきた65歳元会社員が老後破産まっしぐら…遅くに授かった「ひとり娘」溺愛の果て
THE GOLD ONLINE(ゴールドオンライン) / 2024年11月21日 8時45分
-
4「無性にコーヒーが飲みたい…」 実は鉄分不足が原因? 疲労増&集中力低下も
オトナンサー / 2024年11月27日 8時10分
-
5「ワンタッチ痴漢」と言わないで…性犯罪を軽んじる言葉に警鐘 発信源と報道された警視庁に聞いた
まいどなニュース / 2024年11月28日 7時10分
記事ミッション中・・・
記事にリアクションする
![]()
記事ミッション中・・・
記事にリアクションする

エラーが発生しました
ページを再読み込みして
ください