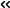がん抑制に重要な役割を果たす転写伸長マークが導入されるメカニズムを解明
Digital PR Platform / 2024年4月30日 10時0分
研究成果
研究グループはクライオ電子顕微鏡を用いて、ヒトのBre1複合体がヌクレオソームに結合した状態の構造を解析しました(図1)。得られた構造において、Bre1複合体とヌクレオソームは主に2箇所で相互作用していました。最初の箇所は、ヒストンH2AとH2Bの酸性アミノ酸残基が集中する「酸性パッチ」と呼ばれる領域で、ここにBre1複合体の一つのサブユニットが結合していました。二番目の箇所はヌクレオソーム上のDNAで、ここに別のサブユニットが結合していました。
[画像1]https://digitalpr.jp/simg/1706/87484/500_211_20240426131352662b2a0070a2b.jpg
図1 Bre1複合体がヌクレオソームに結合した構造(2方向で示す)
この構造と先行研究に基づき、研究グループはユビキチン化反応が起こる状態の仮想モデルを構築しました(図2)。このモデルから、Bre1複合体が酸性パッチとDNAの2箇所に結合することで適切な配向を取り、H2BK120との共有結合形成に適した位置にユビキチンを連れてくることが明らかになりました。
[画像2]https://digitalpr.jp/simg/1706/87484/500_176_20240426131404662b2a0c1da6a.jpg
図2 ユビキチン化反応が起こる状態の仮想モデル(反応に必要なE2タンパク質をオレンジ色で、ユビキチンを灰色で示す)。左:全体構造。右:H2BK120のクローズアップ図。ユビキチン化において共有結合が形成されるユビキチンの76番目のグリシンがH2BK120の近くに存在する。
本構造の特徴は、Bre1複合体がヌクレオソームDNAに直接結合している点です。先行研究では、ヌクレオソームDNAの柔軟性に影響を与えるヒストン修飾(ヒストンH3のチロシン41のリン酸化など)がBre1複合体によるH2BK120のユビキチン化を促進することが明らかにされていました。この知見と、本研究で解明された複合体の構造を統合することにより、ヌクレオソームDNAの柔軟性がBre1複合体の適切な配向を可能にし、H2BK120の効率的なユビキチン化を促進するという制御メカニズムが明らかになりました。
今後の展開
本研究により、H2BK120のユビキチン化レベルの異常が関係するがんの新しい診断法、検査法、および治療法の開発に寄与することが期待されます。また、H2BK120のユビキチン化がヌクレオソームDNAの柔軟性を変える他の現象(ヒストン修飾や他のクロマチン因子の結合など)と互いに影響を及ぼし合う可能性が示唆されました。さらなる研究の進展により、そのような複雑なゲノム機能制御メカニズムの全体像解明が進むと期待されます。
この記事に関連するニュース
-
がんを支える遺伝子発現を調節する因子を新たに発見―がんの新規創薬標的部位の同定―
PR TIMES / 2024年7月29日 15時15分
-
早大など、進化の過程で失われた可能性がある幻のタンパク質構造を発見
マイナビニュース / 2024年7月23日 19時11分
-
がん細胞に薬剤を高効率に取り込ませる新たな手法を発見 抗がん剤を効果的に送り込む「薬物送達ベクター」の開発応用に期待
Digital PR Platform / 2024年7月18日 14時5分
-
「プログラム可能」な新DNA編集技術 東大などが発表 さまざまな2つのDNAを切って組み換え
ITmedia NEWS / 2024年7月11日 8時0分
-
2型自然免疫細胞(ILC2)の新規分化メカニズムを解明~難治性アレルギー疾患の新規治療法開発に期待~
PR TIMES / 2024年7月9日 11時45分
ランキング
-
1スマホより小さなミニPC「S100-WLP」 MINISFORUMから
J-CASTトレンド / 2024年7月29日 12時0分
-
2地方銀行の売れ筋ランキングで「半導体株」と人気を二分するのは…キーワードは「利回り」!?
Finasee / 2024年7月29日 7時0分
-
3ドンキでバカ売れの家電「置くだけエアコン」 担当者「特に人気の地域がある」、なぜ?
ITmedia ビジネスオンライン / 2024年7月29日 12時0分
-
4タリーズコーヒー、創業記念にこだわり「バニラアフォガートシェイク」発売 限定ボトルもかわいい
J-CASTニュース / 2024年7月29日 7時0分
-
5モンスト「インド進出」に懸けるMIXIの腹づもり 屋台骨の"方針転換"の背景を木村社長に直撃
東洋経済オンライン / 2024年7月29日 8時0分
複数ページをまたぐ記事です
記事の最終ページでミッション達成してください