新型コロナワクチンはなぜこんな短期間で大量に作ることができたのか
プレジデントオンライン / 2020年12月19日 11時15分
■最新医療技術が叶えた新型コロナのmRNAワクチン
本格的な冬になりました。コロナウイルスのワクチンに期待が寄せられています。イギリスやアメリカで接種が始まったワクチンは、「メッセンジャーRNA」(以下、mRNA)、と呼ばれる新しい技術を使ったものです。
コロナウイルスのmRNAワクチンは、どの従来型ワクチンにも属さない全く新規のものです。mRNAワクチンの技術は、水面下でどんどん進んでいたバイオテクノロジーを用いた最新医療技術の発露のひとつです。
従来のワクチンは、①ウイルスの活性を失わせた不活化ワクチンと、②弱毒化させた生ワクチンに分類されます。肺炎球菌ワクチンもインフルエンザワクチンも不活化ワクチンです。日常的に接種間隔を調節しながら臨床で用いられています(注1)。
従来のワクチンは卵などの生きた細胞内でウイルスそのものを増やして利用します。mRNAワクチンは、専門の場所で遺伝子そのものを大量合成して作るものです。最新技術の粋を集めて作られたもので、作り方からして全く別ものです。
私は、RNA医療の第一人者である位髙啓史教授(東京医科歯科大学生体材料工学研究所)に、最新型mRNAワクチンについて疑問に思っていることを伺ってきました。2020年11月開催されたmRNA医薬品に関する国際学会で発表されました(注2、注3)。

少し専門的になりますが、伺ったお話を先に紹介します。
■新型コロナのmRNAワクチンのメカニズム
遺伝子を治療に用いる時代がやってきているところでした。今回、このようなmRNAを用いた遺伝子治療が幕を切って始まりそうな時期に、コロナウイルスの世界的流行が一致しました。
新型コロナウイルスで用いられることになったmRNAワクチンは根本から違っています。ウイルスの大量増殖は行いません。遺伝子情報を用います。
RNAを選択し加工する
遺伝子とは、いわばタンパク質を作るための暗号です。ワクチンを作るためには、まずウイルスの遺伝子全体を調べて、ワクチンを作るための必要な遺伝子の一部分を選択します。

次いで、その選択された部分の遺伝子情報を持つmRNAを設計し、mRNAが身体の中でウイルスの一部であるタンパク質を作るようにmRNAを人工合成します。mRNAから作られたタンパク質がワクチンとして働きやすいようにする技術も研究されています(注4、注5)。
薬物送達システム(drug delivery system、DDS)
設計通りに作られたmRNAは専用の場所で大量生産されます。そのままでは、私たちの細胞内に入りにくいので細胞膜を通過する加工をします。
細胞膜を通過しやすい脂質ナノ粒子やポリマー粒子を用いることで、mRNAを私たちの細胞内に運ぶことができます。「mRNAだけでなく、どのように細胞内に運ぶかという方法や素材も重要で研究が進められている」(位髙教授)とのことです。
薬物送達システム(drug delivery system、DDS)と呼ばれています。
mRNAワクチンは筋肉注射、液性免疫と細胞性免疫を作る
mRNAワクチンは、従来型ワクチンでも行われる筋肉注射です。mRNAが運ばれる組織は主に筋肉になり、細胞内でウイルスタンパク質が作られ細胞内を移動し細胞外に分泌されます。自己と異なるタンパク質であるため免疫細胞が認識し、新型コロナウイルスへの抗体が作成されます。
「さらにmRNAワクチンが優れているのは、別経路を活性化して細胞性免疫も誘導する点」(同)とのことでした(注6)。
安全性と生産性
従来型ワクチンとの違いは安全性と生産性の違いにもあります。位髙教授によると、
「安全性と生産性(safety and manufacturing)がmRNAの国際会議でのホットな話題」だったそうです。
位髙教授は「超低温に保たなくてはいけないのは主に輸送と保存についてだろう」と指摘しました。現場で筋肉注射できるように加工されたmRNAは、脂質ナノ粒子やポリマー粒子に守られていて裸の状態ではありません。そのため、「投与前に室温に戻しても一定時間は安定だろう」とのことです。mRNA治療について大切なお話を長時間伺えたことをここに深謝申し上げます。
■従来型ワクチンとは製造過程から違う
位髙教授にお伺いした内容を元にmRNAワクチンの特徴を考えてみましょう。
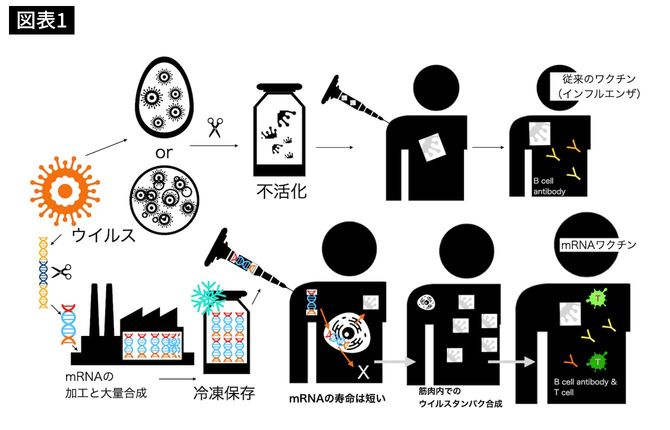
上段の従来のワクチンと下段のmRNAワクチンでは製造ラインは全く異なります(図表1)。従来のワクチンは、目的となる細菌やウイルスを培養することが最初のステップになります。
例えば、インフルエンザワクチンは、鶏卵や専用の細胞内で増殖させます。回収された細菌やウイルスをワクチンに加工してバイアルと呼ばれる容器に詰めます。
ウイルスの活性を失わせれば不活化ワクチンに、もともと弱毒化したウイルスをそのまま用いれば生ワクチンになります。
■従来型ワクチンにかかる手間と時間
不活化ワクチン内には、ウイルスの特徴を持ったタンパク質粒子が多量に含まれています。インフルエンザワクチンの電子顕微鏡写真では、インフルエンザウイルスを特徴づける外側のタンパク質の散在を確認できます(注7)。水溶液にウイルスタンパク粒子が均一に分散しているので、冷蔵保存となります。冷凍してはいけません。
ワクチン成分を体内の免疫細胞が認識すれば良いので、皮下注射や筋肉注射することになります。インフルエンザ不活化ワクチンでは主にB細胞由来の抗体を作ります。本物のウイルスが体内に入ってきた時に、素早く免疫システムが発動します。
生きたウイルスを純粋培養してワクチンを作るのには、幾つもハードルがあります。ウイルスは、生きた細胞内で増殖します。ウイルスによって増殖できる細胞の種類が限られています。ウイルスが増えてくると宿主の細胞を痛めてしまい必要な収穫量を得ることができないこともあります。
また、鶏卵で培養を繰り返しているうちに元のウイルスとは異なる卵で増えやすいウイルスに変化してしまう「卵馴化(らんじゅんか)」が問題になることもあります(注8)。気がついたらオリジナルのウイルスが無くなって増えやすいタイプに変化したインフルエンザウイルスばかりになってしまっていた、というものです。海外ではインフルエンザウイルスを培養細胞で増殖させてワクチンを作っています。
このように従来型のワクチンでは、まずウイルスそのものが必須です。次にウイルスを増やすための細胞を培養する準備、そして細胞内でウイルスを増やす手間と時間が必要となります。卵や細胞培養容器といった生体を扱う空間も必要になります。
■mRNAワクチンは従来型と根本から違う
一方、mRNAワクチン作成では、ウイルスの遺伝子解析から始まります。ウイルスの遺伝子の中でヒトに免疫を誘導する部分の遺伝子配列を探します。それをもとにワクチン用の遺伝子を設計します。
設計図をもとにして同じmRNAを大量生産します。細胞内に運んでくれる担体と合わせることでワクチンとなります。mRNAワクチンには、ウイルス由来のものは含まれません。
ワクチンはたくさんの方に接種するので、mRNAを大量生産する技術が必要です。ペニシリンも発見されてから大量合成できるようになるまで長い道のりがありました(注9、注10)。
新型コロナについてはファイザー社やモデルナ社がmRNAワクチンとして細胞内に運ぶ担体としてナノ脂質粒子を用いています。一方、アストラゼネカ社は人間の体内では増殖しないウイルス(ウイルスベクターと呼びます)を用いています。
ワクチンは多くの人に用います。小ロットを作るのとは違って大量に供給するための安全性と生産性(safety and manufacturing)が重要問題になります。
また、各製薬メーカーは得られた最新の遺伝子情報を用いて、いかに「mRNAが効率よく細胞内に副作用が少なく運ばれ」て「効果的に免疫を作るタンパク質を作りだせるか」ということに鎬(しのぎ)を削っていきます。

■mRNAワクチンは筋肉注射
mRNAワクチンは、人体に投与する前に解凍して室温に戻して筋肉注射します(注5)。私は、mRNAが免疫細胞に入って色々な免疫システムが誘導されるかもしれないと思っていましたが、主たるワクチンの到達先は筋肉細胞でした。
筋肉内に注射されたmRNAワクチンは薬物送達システムによって、細胞膜に取り込まれ速やかに筋肉細胞内に移動します。
DNAではないので、私たちの核に組み込まれることはありません。細胞の中の細胞質と呼ばれるところで、即座にウイルスタンパク質を合成し始めます(注11)。役割を終えるとmRNAは短時間で体内から消失します。
このウイルスタンパク質に対して、液性免疫と細胞性免疫の両者のシステムが発動しウイルスに対して抵抗力を得ることができます。これが、高い効果を生んでいると考えられます。
■mRNAワクチンが有利な点
遺伝子情報が公開されていれば、感染力のあるウイルスそのものが無くてもワクチンを作ることができる点が大きな利点です。遺伝子変異が発表されれば、それに合わせて作り替えていくことができます。また、新規感染症にも迅速に対応できます。
投与されたmRNAはウイルスのタンパク質を作って役割を終えると短時間で壊されてしまうので、体内に残ることはありません。mRNAの寿命が短いことが安全性につながっています。
mRNAは壊れやすいので即座に冷凍保存され輸送されます。
私は、臨床で働いているので研究用の超低温冷凍庫が必要だったりクリーンルームではない通常の現場ですぐに壊れてしまったりするものだったりしたら困ると思っていました。生体細胞から採取したRNA実験の煩雑さを思いだしていたからです。
ワクチン化されたmRNAは、RNAを破損する酵素などの物質が入り込まない専用のクリーンルーム化された製薬工場で作っているため安定性が高いと言われています。注意深く運ばれてくれば、臨床現場で通常使用ができそうです。
■ガンや糖尿病の治療でも注目されるmRNA治療
今回、ワクチンで注目されたmRNA治療。ガンの治療でも注目されています。
ガン細胞は免疫システムから逃れて増殖します。免疫システムにブレーキをかける「免疫チェックポイント」をブロックする、免疫チェックポイント阻害薬が広く用いられるようになりました(注12)。
まず人それぞれのガン細胞を採取して、遺伝子を解析します。ガン特有のタンパク質に合わせて、その人用のmRNAを設計することができます(注13)。
免疫チェックポイントを薬剤で外しておいて、その「ガンワクチン」を投与します。すると免疫細胞の目をかいくぐれなくなったガン細胞を、ガン特有のタンパク質を認識する免疫システムが攻撃してくれます。
私たちの免疫システムが、ウイルスのように効率よくガンを排除してくれるわけです。もしこの作業が流れ作業になれば、体内にできてくるガンや細胞内の厄介なものを免疫システムに認識してもらうテーラーメイド医療が簡便にスピーディーに行えます(注14)。
インスリンを作れなくなって糖尿病になった(I型糖尿病)患者さんの膵臓にインスリンを作り出す細胞を作り出す遺伝子治療も試されるようになりました。また、通常のII型糖尿病の患者さんに特徴的な遺伝子異常が見つかってきています(注15、注16)。
発現が少ないタンパク質をmRNAで補っていけば、発症予防や治療ができるかもしれません。このように、疾患の遺伝子的な解析が進むのと並行して、遺伝子を用いた治療が進化しています。
■mRNAワクチンは未来医療の入口になる
mRNAを用いた新型コロナウイルスワクチンは、人類がこれから広く用いていこうとしている遺伝子治療の入り口にある技術でした。大量生産され、多くの人に使われることになります。それは、人類が抗生物質を使えるようになり大量生産され世界中に普及したことと重なります。
がん治療や、心筋梗塞、アルツハイマー病やパーキンソン病などの脳疾患、糖尿病など数多くの疾患の治療のためにmRNAを用いた研究が進んでいます。
また、位髙教授は面白い未来の可能性も教えてくださいました。「ダイレクト・リプログラミング」(direct reprogramming)という技術です(注17)。細胞内に発現するタンパク質をコントロールすることにより細胞の性質を変えるという技術です。位髙先生の総説がよくまとめられています(注18)。
■治療の革新的パラダイムシフトが起こっている
遺伝子を用いたワクチンにも様々なものが開発されており、今後も新しいものが登場してくることでしょう(注19)。従来の治療方法からのパラダイムシフトが起きていることは確実です。遺伝子そのものを医療的に大勢の人々に使って普及するという未来が、mRNA新型コロナワクチンとして私たちの前に登場したのです。
ガソリンエンジン車から電気自動車にパラダイムシフトし、新規会社が勢力地図を広げています。遺伝子治療の水平線でも、世界が同じスタートラインにリセットされました。安全な新しい遺伝子治療薬を量産するためには、半導体製造のようなクリーンルームが必要であることが化学工業日報に掲載されています(注20)。
日本が得意な分野で、国産の遺伝子ワクチンも開発されています。半導体技術で世界を工業立国としてリードした日本が、遺伝子新規医療でも飛躍していくことを願っています。
■English abstract
Making large quantities of vaccine against COVID-19 within a short period of time: Why?
mRNA vaccine is a one of the few surprising cutting-edge gene therapies
In recent years, various treatment methods using genes have been developed, whereas the current circumstances feature the COVID-19 epidemic, which has recently occurred. Thus, the rapid mass production of mRNA vaccines has been realized due to the coincident development of the pandemic and vaccine.
The mRNA vaccine for COVID-19 is fundamentally different from conventional vaccines, which use only the genetic information of viruses without live virus proliferation.
When the mRNA vaccine is delivered via intramuscular injection, the muscle cells produce viral proteins. Thus, the vaccine induces cell-mediated immunity as well as antibodies by humoral immunity.
Although mRNA vaccines are produced in large quantities in clean rooms, “safety and manufacturing” has become a hot topic of debate among academic circles.
If the mRNA vaccine is composed of the genetic information of proteins produced by cancer cells, then it should be a “cancer vaccine.” In addition, it may be used to treat diabetes and Alzheimer's disease because mRNA introduces adequate protein into the body.
The mRNA treatment method is currently considered an mRNA vaccine. However, its establishment as novel essential treatment methods in the future is promising. I hope that Japan will play a part in realizing this vision.
I would like to express my deepest appreciation to Dr. Keiiji Itaka (Professor, Institute of Biomaterials and Bioengineering, Tokyo Medical and Dental University) for the help and support.
<参考文献>
1.ワクチンの接種間隔の規定変更に関するお知らせ 厚労省
2.8th International mRNA Health Conference
3.Treat diseases by regulating cell functions in the body. Department of Biofunction Research
4.2本鎖mRNAを設計し、mRNAワクチンの効果を飛躍的に向上 mRNA分子に免疫賦活化アジュバント機能を一体化 東京大学工学部
5.「免疫賦活化効果を高めた核酸を用いたワクチンの開発」 東京大学、東京医科歯科大学
6.COVID-19の打倒を目指す新たなmRNAワクチンのご紹介 Yingzhu Li, CAS Division of the American Chemical Society September 2, 2020,
7.インフルエンザワクチンの製造と課題
8.H3N2亜型にはワクチンが効かない? 日経メディカル 2019/12/09
9.ペニシリンの発見から製品化までの道のり KAJIMOTO Tetsuya 梶本 哲也
10.『知らずに飲んでいた薬の中身』大和田潔著、祥伝社新書(165)pp.145-pp.146
11.Optimization of Lipid Nanoparticles for Intramuscular Administration of mRNA Vaccines Kimberly J. Hassett, et al. Molecular Therapy Nucleic Acid Volume 15, P1-11, April 15, 2019
12. 免疫療法 もっと詳しく知りたい人へ 国立がんセンター
13.mRNA癌ワクチン 日経バイオテク 2017.11.06
14.注目を集める個別化がんワクチンガンの個別化にRNAワクチンはいい ハイライト ARC WATCHING 2018年12月
15.1型糖尿病の遺伝子治療を可能にする膵臓特異的遺伝子デリバリーシステムの開発
16.日本人集団の2型糖尿病に関わる新たな遺伝子領域を発見 日本医療研究開発機構
17.mRNA-Based Genetic Reprogramming Luigi Warren1, et.al. Mol Ther. 2019 Apr 10; 27(4): 729-734.
18.総説 mRNA医薬開発の世界的動向 位髙啓史らレギュラトリーサイエンス Vol. 50 No. 5(2019)PMDRS,50(5),242~249(2019),
19.DNA・mRNA・ベクター… 多様なワクチンの違いは? 日本経済新聞 2020年7月27日,
20.東京医科歯科大・位髙教授が講演、mRNAの新型コロナワクチン、強い免疫反応に期待 化学工業日報 2020年12月06日
----------
医師
1965年生まれ、福島県立医科大学卒後、東京医科歯科大学神経内科にすすむ。厚労省の日本の医療システム研究に参加し救急病院に勤務の後、東京医科歯科大学大学院にて基礎医学研究を修める。東京医科歯科大学臨床教授を経て、秋葉原駅クリニック院長(現職)。頭痛専門医、神経内科専門医、総合内科専門医、米国内科学会会員、医学博士。著書に『知らずに飲んでいた薬の中身』(祥伝社新書)、共著に『のほほん解剖生理学』(永岡書店)などがある。
----------
(医師 大和田 潔)
外部リンク
この記事に関連するニュース
-
クラリベイトが年次レポート「Drugs to Watch 」を発表
共同通信PRワイヤー / 2025年1月21日 13時30分
-
【東京医科大学】肝線維化を制御する経口投与可能な核酸医薬品の開発 ~ 飲み薬で肝硬変を改善する方法を目指して 〜
Digital PR Platform / 2025年1月20日 14時5分
-
ヒト21番染色体部分モノソミーiPS 細胞の作製に成功 ~ヒト染色体欠失症やダウン症の機序解明や治療標的発見への応用を期待
Digital PR Platform / 2025年1月15日 14時5分
-
インフルやマイコプラズマ肺炎の患者激増…薬が手に入らない…重症化させないために今すぐすべきこと
日刊ゲンダイDIGITAL / 2025年1月7日 9時26分
-
新型コロナ以外の国内治験も進みmRNAワクチンが発展する【2025年の医療を予想する】#4
日刊ゲンダイDIGITAL / 2025年1月2日 9時26分
ランキング
-
1お金でも名声でもない…ハーバード大教授の75年間の追跡調査で分かった「幸せな人生」に欠かせない重要要素
プレジデントオンライン / 2025年1月27日 8時15分
-
2「カキ」にあたる人・あたらない人、何がどう違う?→実は「あたりやすい人」には特徴があった【医師解説】
オトナンサー / 2025年1月27日 7時10分
-
3腸活のトレンドは●●! 40・50代が今すぐ取り入れたい腸が若返る秘訣
つやプラ / 2025年1月27日 12時0分
-
4車の希望ナンバー「358」人気、なぜ? 意味分かれば「1031(天才)!」だよ!? 悩んでも分からない…「謎の数字」の由来は? 意外と付ける人多いらしい
くるまのニュース / 2025年1月27日 8時10分
-
556歳・年収600万円男性「月30GBもスマホのデータ通信が使えてかなりお得感がある」買ってよかった株主優待銘柄とは?
オールアバウト / 2025年1月26日 12時20分
記事ミッション中・・・
記事にリアクションする
![]()
記事ミッション中・・・
記事にリアクションする

エラーが発生しました
ページを再読み込みして
ください










