「紅麹サプリ」の教訓を忘れてはいけない…安全で体に良いとは限らない「機能性表示食品」の実態
プレジデントオンライン / 2024年5月28日 10時15分
■「悪玉コレステロールを下げる」という売り文句
小林製薬の紅麹サプリメントによる健康被害問題はいまだ、原因がつかめないままです。同社が把握している健康被害は、延べ相談件数が12万1000件、医療機関を受診した人が1603人、入院した人278人、死者数5人に上り、1日に1000件程度の相談が寄せられる状況です(5月23日現在)。
紅麹サプリメントは機能性表示食品。消費者は、容器包装の「悪玉コレステロールを下げる」という機能性に惹きつけられました。人気の製品であったが故に被害が拡大したのは疑いようもなく、機能性表示食品制度への批判も高まっています。
消費者庁は3月末、「機能性表示食品を巡る検討会」を設置し、検討しました。とはいえこの制度、功罪両面ありました。今回は、制度を改めて検証します。
■かつて販売されていた「トンデモ健康食品」
機能性表示食品制度の“功績”は、健康食品の事業者や報道機関に安全性や機能性の科学的根拠(エビデンス)という概念をきちんと浸透させた点にある、と私は思います。
健康食品業界は、大手から中小まで開発力も科学的な判断力も千差万別。昔はとんでもない事業者が多かった、というのが私の実感です。培養細胞・動物試験の結果や体験談をチラシなどに掲載し「健康食品」として販売するところが多くありました。ヒトが食べての試験による効果など検証されていないのに、効果ありとアピールするのです。
効果・効能をうたうのは、薬事法(現薬機法)違反にも問われかねないので、容器包装への表示や広告宣伝は表現を工夫する一方、口頭で「あの人はこれで治った」などとセールスします。書籍で効果効能を詳しく説明し、「この書籍で取り上げられた成分を含むこの製品は……」と売りつける「バイブル商法」など、売らんかなのテクニックもさまざまありました。
■エビデンスピラミッド最下層の製品がぞろぞろ
私は、2005年に『「食品報道」のウソを見破る 食卓の安全学』(家の光協会)を出版したのですが、そこで「体験談は信用度ゼロ」「動物実験にごまかされてはいけない」などの項目を立てて説明しています。事業者だけでなくテレビなどのメディアも、健康効果の根拠として堂々とこれらを取り上げ、ひどい状況でした。
図表1のエビデンスのピラミッドは、医薬品や治療法、食品の機能性などの根拠の強さについて、トップクラスのメタアナリシス・システマティックレビューから一番低いin vitro(試験管内)で行う細胞試験までを図示した有名なものですが、昔は下の方の試験結果しかない成分や専門家のお墨付きだけの「健康食品」が当たり前、だったのです。
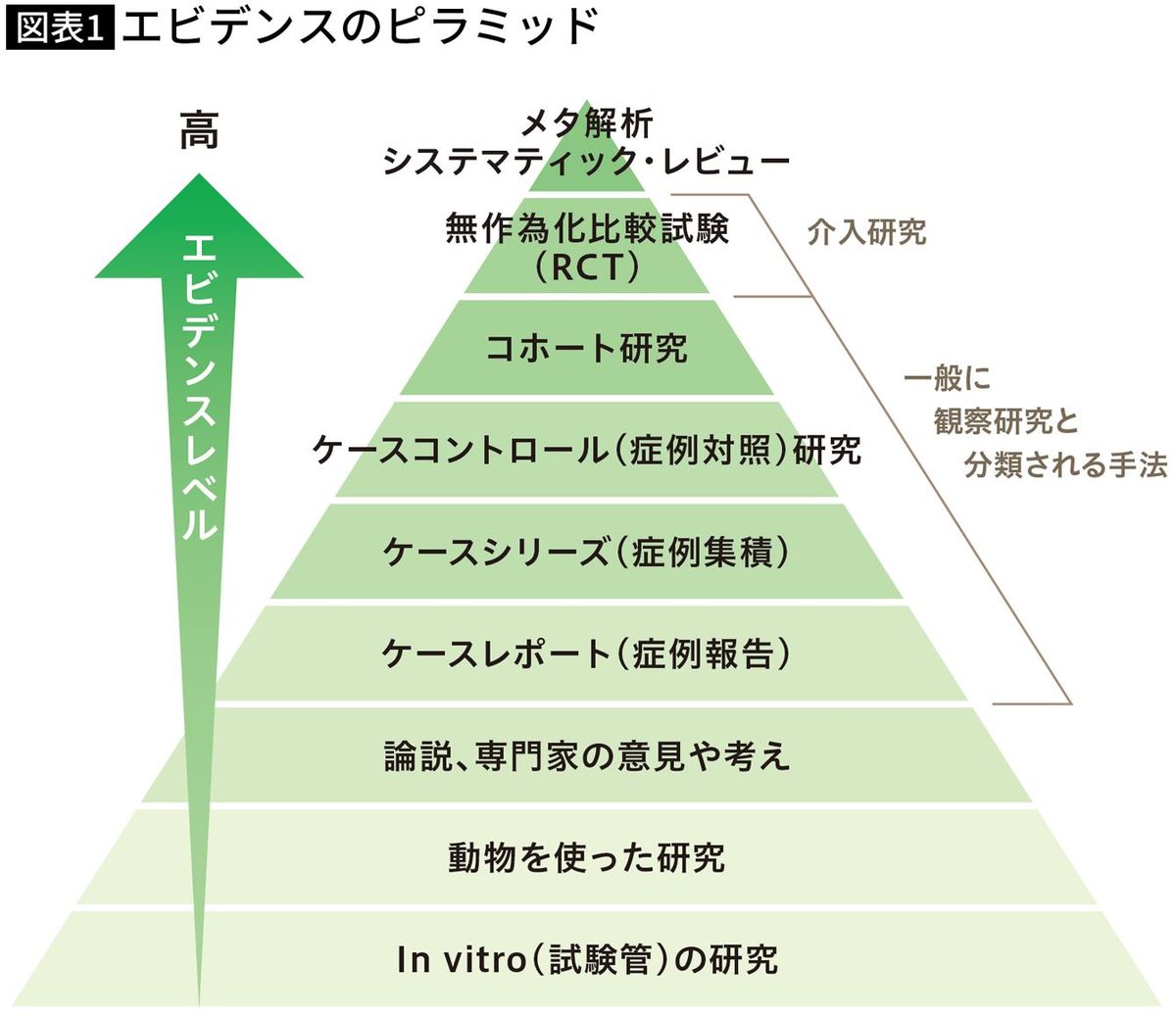
私が取材する限り、エビデンスの弱さを自覚しながら売る事業者はまだマシで、なにが悪いのか、なぜ細胞や動物を用いた試験で効果があるだけではダメなのか、理解していない事業者がいました。安全性についても「自然だから」「食品だから」問題ない、というレベルの理解しかないのです。なのに、「製品で、消費者の健康に貢献したい」と公言し、無知の“善意”を見せつけられる状況でした。
■エビデンスが事業者に浸透した
それが、機能性表示食品制度によって大きく変わりました。この制度は、消費者庁が機能性や安全性等についてガイドラインを示し、事業者がそれに従い、自己責任で書類を届出て機能性を表示できるようになります。
当然、ヒトでの試験結果が必要で、機能性については図表1のエビデンスのピラミッドなら、1番上のメタ解析・システマティックレビュー(研究レビュー)か2番目の無作為化比較試験が求められます。安全性についても一定の水準がガイドラインで示されています。
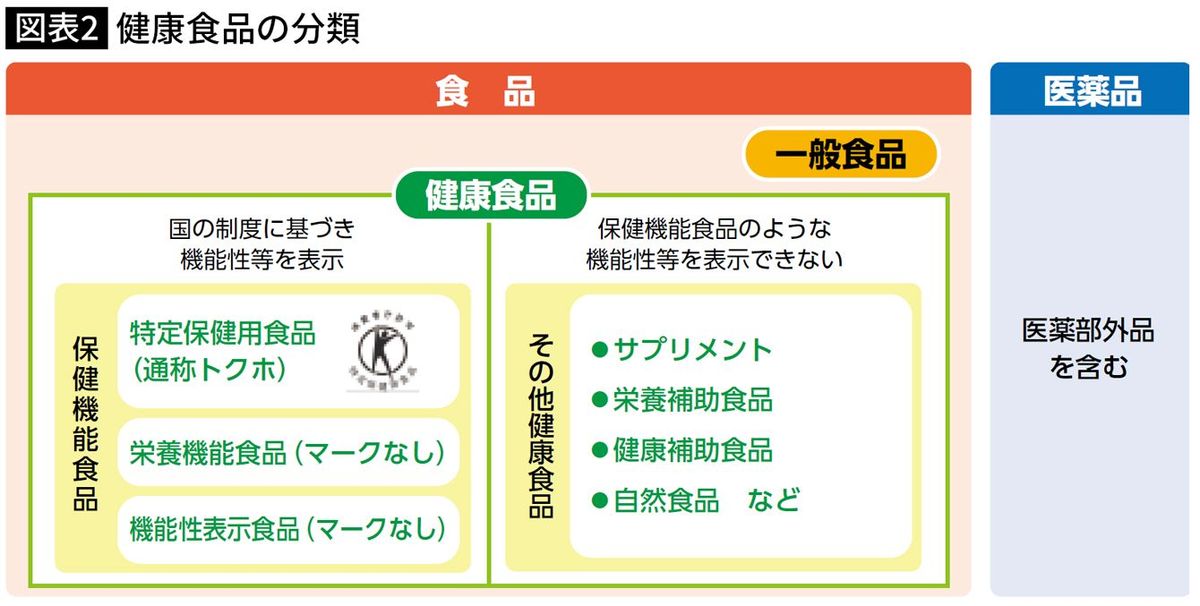
以前からあった特定保健用食品(トクホ)は、国が特定の製品を審査し表示を許可するもので、ヒトの試験結果が求められ安全性も詳しく評価されていました。しかし、トクホは情報開示が著しく少なく、許可までに長い歳月と億を超える費用が必要とされ、中小事業者にとっては“関係ないもの”。機能性表示食品制度により、業界関係者にとってエビデンスが“自分事”になったのです。これにより業界で、エビデンスという概念が定着した、と事業者自身からも聞きました。
■「その他健康食品」よりは選びやすいが…
消費者庁から図表2のような説明図も示され、消費者にとってもおのおのの食品の位置付けがわかりやすくなりました。ばくぜんとした「その他健康食品」よりは、国の制度に則って「機能性表示食品」と表示された製品のほうが消費者も選びやすかったでしょう。
ちなみに、今も、機能性等を表示できない「その他健康食品」が「がんを抑える」などと病気への効果・効能をうたい、薬機法違反で摘発される事件が起こります。5月9日にも、福井県警が「大腸がん抑制効果」を広告しサプリメントを販売していた社長を逮捕したことが報道されました。
とはいえ、昔はもっとひどい状況だったのです。
■お粗末なエビデンスでアピールする“罪”
結局のところ、機能性表示食品は思わせぶりに効果をアピールする「その他健康食品」よりはマシです。しかし一方で、「その程度のお粗末なエビデンス、しかも小さな機能性。そして、安全性は検討不足にもかかわらず、そこまで派手に包装に表示し、おおげさに広告宣伝しますか?」という機能性表示食品も氾濫している、というのが今の状況についての私の見立てです。
やはり、“功”よりも、国民に「効くかも」「安全かも」と錯覚させだます“罪”の方が圧倒的に大きい、と感じます。
エビデンス不足については既に、さまざまな事例が報道されていますが、ここでは「特定保健用食品」(トクホ)との関係で興味深い事例を紹介しましょう。トクホは国が表示を許可しており、第三者である専門家が内容をチェックします。機能性表示食品と同じ成分を同じ量含む製品がトクホとして申請されましたが、許可されなかったことがあります。
機能性表示食品として届け出られたのが「蹴脂粒(しゅうしりゅう)」。トクホとして申請されたのは「蹴脂茶」です。
機能性表示食品としての届出書類によれば、機能性は「キトグルカン(エノキタケ抽出物)を配合しており、体脂肪(内臓脂肪)を減少させる働きがある」。1日あたりの摂取目安量に含まれる機能性関与成分の含有量は、エノキタケ由来遊離脂肪酸混合物として2.4mg。
安全性についてはラットやマウスで試験を行ったほか、計24人を対象に摂取目安量の5倍量を4週間連続して摂取する試験で異常がなかったことや、計80人を対象に摂取目安量を12週間食べてもらう試験で異常がみられなかったことを根拠として、2015年4月に届出されました。
■トクホ審査では安全性が確認できず
一方、トクホとして2013年に申請されていたのは、同じエノキタケ抽出物を含む蹴脂茶。粒と飲料という違いはありますが、トクホ審査に提出された試験成績等は、機能性表示食品として届出されたものとほぼ同様とみられます。
食品安全委員会は2015年5月、トクホとしての安全性の評価をまとめました。事業者の説明した作用機序について「生体内において実際にその機序で作用していると判断するには十分なデータが示されていない」と判断。そのうえで、「事業者の説明する作用機序を前提とすれば、提出された資料からは安全性が確認できない」と結論づけました。
なんともわかりにくい言い回しですが、事業者が、効果を示すエノキタケ抽出物の作用機序について、「脂肪細胞の表面に存在するβ3-アドレナリン受容体に結合することで、脂肪細胞中の脂肪滴の肥大化を抑制する」などと説明していたことが問題でした。
食品安全委員会の専門家は「β-アドレナリン受容体にはβ1、β2、及びβ3という3種のサブタイプが存在するが、本食品の関与成分の選択性は低く、非特異的に全てのサブタイプに結合するおそれがある」と考えました。
そのため、「本当に、そんな作用機序で効いているなら、体内のさまざまな細胞のβ-アドレナリン受容体に結合することになり、動悸、頻脈、不整脈、血圧上昇等の疾患につながるよ。でも、そんな作用で効いているとは思えないけどねえ」と判断したのです。
■事業者は機能性表示食品として再び届出
食品安全委員会が蹴脂茶のリスク評価をまとめ「安全性を確認できない」としたことで、蹴脂茶はトクホとして認められませんでした。これらの議論は、評価書や食品安全委員会・新開発食品専門調査会の議事録として今も公開されています。
片や届出、片やトクホ却下。2015年当時は話題になったのですが、古い話なので、ほとんどの人が忘れています。ところが、話はこれで終わりませんでした。
機能性表示食品として2015年4月に届け出た蹴脂粒は18年8月、「届出表示文言変更のため」という理由で届出を撤回されました。そして、機能性関与成分名を「エノキタケ由来脂肪酸(リノール酸、α-リノレン酸)」に、1日の摂取量を1.2mg(リノール酸0.9mg、α-リノレン酸0.3mg)に変更して、2019年から計11件、機能性表示食品が届出されているのです。
以前の関与成分は、遊離脂肪酸混合物2.4mgでリノール酸やα-リノレン酸、ペンタデカン酸等で構成される、と説明していましたので、関与成分をリノール酸とα-リノレン酸に絞った、ということでしょう。
■「これまで被害が出ていないから、安全だ」
成分名が変わっていても、内容は蹴脂粒とほぼ同じ。事業者が提示した作用機序も、言い回しは違いますがほぼ、蹴脂粒やトクホの蹴脂茶として申請されたものと同様です。安全性の根拠も、トクホのリスク評価書で論じられた試験成績とあまり変わらず、ヒトでの過剰摂取試験の用量がトクホでは2.85倍、機能性表示食品では5倍量になっているだけ。
食品安全委員会が動物の飼育環境が不適切であった可能性があるとして「安全性の評価に用いることはできない」と判断した動物試験についても、堂々と根拠の一つとして用いています。作用機序についても、食品安全委員会の「安全性を確認できない」という懸念を解消するような科学的根拠は示されていません。
驚くべきことに、消費者庁に届出された書類の中に、食品安全委員会の評価について言及しているくだりがありました。「食品安全委員会の評価は、関与成分の安全性を否定した内容にはなっておらず、βアドレナリン受容体にする非特異的作用を有するのであれば、心血管系、泌尿器系等への影響を及ぼす可能性は否定できないということに留まっている」と記述し、「これまで類似製品で被害が出ていないから、安全だ」と届出しています(画像1参照)。

■トクホで却下された成分でも受理されてしまう
いやはや、食品安全委員会もコケにされたものです。トクホと機能性表示食品の両方を所管する消費者庁が、この届出書類をすんなり受理するのも不思議ですが、機能性表示食品制度では、消費者庁は届出書類をあくまでも“形式的”にチェックするのみ。したがって、製品の安全性判断に客観性がなく食品安全委員会に従わずとも、制度上は問題がありません。
ちなみに、事業者はエノキタケ抽出物の安全性として1990年から流通していたことや、類似製品の販売歴が10年以上あり危害情報が報告されていないことなどからも安全、としています。
しかし、海外で食経験から安全とみなされるのは、幅広い人たちに20〜25年以上食べられていた実績。しかも、抽出濃縮などを経たものは、もとの食品と同等とはみなされません。エノキタケと、そこから抽出濃縮したエノキタケ抽出物は別もの。エノキタケ抽出物は国民に幅広く喫食されていたわけではなく、海外であれば安全の根拠にはなり得ません。
これでも通るのが、機能性表示食品制度なのです。
■論文1本でも機能性表示食品ではOK
さまざまな機能性表示食品の届出情報を見ると、同様に安全性の根拠について「サプリメントとして販売してきたが、購入者からの情報を解析した結果、健康被害はない」と説明する製品が多数あります。当事者が「健康被害はない」と言い切っても、説得力はありません。
また、機能性の根拠についても、驚くほどレベルの低い製品がいっぱい。たとえば、摂取群と対照群(プラセボ群)を設定して比較しているものの、それぞれの群がたった4人しかいない、というような試験で「統計学的に有意な差があった」として、届出を済ませている製品があります。このような少人数で有意な差うんぬんを語るのは、科学的には意味がありません。
また、「研究レビュー」という方法を悪用していると見える製品も多数あります。機能性表示食品制度においては、機能性の根拠として、製品を摂取する試験結果だけでなく、論文のデータベースで機能性関与成分を検索し、それを解析して効果が認められれば、その関与成分を含む製品を届出してよい、という研究レビュー方式が認められています。
研究レビューは、多数の研究がさまざまな研究者によって行われ、レビューが公正中立に行われて「効果あり」となれば、信頼度の高いエビデンスです(図表1ではメタ解析・システマティックレビューとして最上位に位置づけられている)。
ところが、機能性表示食品においては、研究レビューをしたものの論文が1本しか採択されなかった、という製品がいくつもあるのです。つまり、その関与成分についてはほとんど、研究がなされておらず、1本しか論文がないのです。しかし、それでも機能性表示食品としてはOKです。
また、届出をする企業の社員がレビューを行い、その企業が出した論文一つを選ぶ、という「利益相反」の塊のような研究レビューが行われ届出されている製品もあります。
■「血圧をグーンと下げる」は景表法違反
そもそも、機能性の根拠となる論文の質の低さについては、以前から繰り返し指摘があり、報道もされていました。
こうした問題を、消費者庁も気にしていたようです。2023年6月、機能性関与成分としてDHA・EPA、モノグルコシルヘスペリジン、オリーブ由来ヒドロキシチロソールを含み、「高めの血圧を下げる機能性サプリ」「血圧をグーンと下げる」「酸化LDLコレステロールを減少させる機能性取得」「中性脂肪を低下させる機能性取得」などと表示した2つの機能性表示食品について、景品表示法違反(優良誤認)として表示をやめるよう、事業者に措置命令を行いました。「表示の裏付けとなる合理的な根拠を有していない」と判断しています。

■試験と書類、表示の文言がセットのビジネスモデル
消費者庁は、措置命令の対象となった2つの商品と同一成分で、科学的根拠が同一であるという他の商品88件についても回答を求めており、60件は撤回され、残りも撤回の予定です(2024年4月30日現在)。
機能性表示食品制度においては、原料メーカーが開発業務受託機関(CRO)に依頼し試験や研究レビューを行い、書類の書き方から機能性の表示の文言までセットにして、健康食品事業者に売り込み、その原料を使った機能性表示食品が各社から届出される、というビジネスモデルが確立しています。そのため、科学的根拠が同一の製品88件がいっせいに撤回へ、ということになるのです。
京都大学の研究グループも24年2月、論文で食品の機能性研究の質の問題を明らかにしています。CROにより実施された臨床試験の論文およびそれを基にした広告に、優良と誤認させる要素が多く含まれている、というのです。
論文で取り上げられた試験の多くは、機能性表示食品の根拠となっています。京大グループは「国、あるいは消費者庁が、機能性表示食品について規制の見直しを検討すべきであることが示唆されました」と広報しています。
■消費者庁は制度にメスを入れられるか?
多くの消費者は、こうした実態に気付かぬまま、国の制度だからと機能性表示食品を信頼していたはずです。消費者庁は数年前から健康食品に厳しく対処し、景表法違反などで次々に措置命令を出していました。昨年ついに、機能性表示食品のエビデンス不足にも対処したので、私は、その後も制度にメスを入れるもの、と期待していました。ところが、急に低調に。その挙句、紅麹サプリメントの健康被害が発生した、というわけです。
消費者庁は今後、制度をどうするつもりなのでしょうか?
※記事は、所属する組織の見解ではなく、ジャーナリスト個人としての取材、見解に基づきます。
<参考文献>
機能性表示食品・蹴脂茶
内閣府食品安全委員会・蹴脂茶評価書
内閣府食品安全委員会・新開発食品専門調査会第93回、101回、102回会合議事録
消費者庁機能性表示食品の届出情報検索で、機能性関与成分名=エノキタケ由来脂肪酸で検索
消費者庁・機能性表示食品について
----------
科学ジャーナリスト
京都大学大学院農学研究科修士課程修了。毎日新聞社の記者を経て独立。食品の安全性や環境影響等を主な専門領域として、執筆や講演活動などを続けている。主な著書は『ゲノム編集食品が変える食の未来』(ウェッジ)、『メディア・バイアス あやしい健康情報とニセ科学』(光文社新書、科学ジャーナリスト賞受賞)など。2021年7月より内閣府食品安全委員会委員(非常勤、リスクコミュニケーション担当)。記事は、所属する組織の見解ではなく、ジャーナリスト個人としての取材、見解に基づきます。
----------
(科学ジャーナリスト 松永 和紀)
外部リンク
この記事に関連するニュース
-
“水素を食べる”サプリメント「高濃度水素ゼリー」POPUPストア6月26日(水)~8月27日(火)大丸神戸店にて期間限定開催!
PR TIMES / 2024年7月2日 15時15分
-
“水素を食べる”サプリメント「高濃度水素ゼリー」POPUPストア7月24日(水)~8月13日(火)札幌三越にて期間限定開催!
PR TIMES / 2024年7月2日 13時0分
-
東尾理子さんが主催する「リプロダクティブヘルスアワード2024」で『わたしプロローグ』が「特別賞リプロダクティブ・ヘルス部門」を受賞!
PR TIMES / 2024年6月21日 16時45分
-
ニュートリー、“褥瘡を有する方の食事療法として使用できる食品”として消費者庁許可 個別評価型病者用食品の表示マーク入り飲料「ブイ・クレスCP10(シーピーテン) ルビーオレンジ」を出荷
PR TIMES / 2024年6月19日 17時45分
-
社説:機能性表示食品 健康被害の歯止めこそ
京都新聞 / 2024年6月14日 16時0分
ランキング
-
1「ぐっすり眠れない人」今すぐ摂るべき5つの食材 「眠りを誘うホルモン」が睡眠の質を高める
東洋経済オンライン / 2024年7月6日 21時0分
-
2日産新型「セレナ“ミニ”」登場は? シエンタ&フリード対抗の「小型ミニバン」は? 実はあった「小さな3列車」 ユーザーの声いかに
くるまのニュース / 2024年7月6日 7時40分
-
3「二重あご」になっちゃう理由 実は肥満だけじゃない 原因&改善法を美容外科医が解説
オトナンサー / 2024年7月7日 7時10分
-
4浴室リフォームを決意、どんな補助金が使える? 「省エネリフォーム」に関する補助金は多い
東洋経済オンライン / 2024年7月7日 8時50分
-
5何もしてないのに「バッテリー上がり」した! 真夏の「突然のトラブル」どう防ぐ? いつか起こり得る「エンジンかからない」どう対処するのがOKか
くるまのニュース / 2024年7月6日 18時10分
記事ミッション中・・・
記事にリアクションする
![]()
記事ミッション中・・・
記事にリアクションする

エラーが発生しました
ページを再読み込みして
ください












