がん細胞に核酸医薬を効率よく取り込ませる新技術TRPC3/C6チャネル選択的活性化剤L687を開発
PR TIMES / 2024年4月17日 17時40分
核酸医薬によるがん治療の新たな選択肢
【お読みいただく前に】
アンチセンス核酸医薬(ASO)※1などの核酸医薬※2は、低分子医薬や抗体医薬とは異なり、タンパク質の発現を遺伝子レベルで制御することから、次世代の分子標的医薬として注目されています。しかし、核酸医薬は、一般の医薬品と比べて分子量が大きく親水性であり、細胞表面の脂質の膜となじみにくいことから、細胞内に移行する割合が極めて低くなっています。そのため、せっかくの核酸医薬の機能が細胞内で十分に発揮されず、その汎用性は大きく制限されていました。核酸医薬をがん治療に応用するためには、核酸医薬のがん細胞内移行性を高める技術の開発が喫緊の課題となっていました。
【研究成果のポイント】
がん細胞に発現するカルシウム透過型TRPC3/C6チャネル※3を選択的に活性化する新規化合物L687の取得に成功
L687の添加により、アンチセンス核酸医薬(ASO)が、がん細胞及びマウス腫瘍内細胞へ効率よく取り込まれることを発見
本研究成果により、ASOを用いる新たながん治療法開発の加速に期待
概要
大阪大学 大学院薬学研究科生物有機化学分野の小比賀聡教授、大学院生の小橋博斗さん(研究当時)、下條正仁准教授(研究当時)、永田龍特任准教授らのグループは京都大学 大学院工学研究科 合成・生物化学専攻の森泰生教授らの研究グループ、医薬基盤・健康・栄養研究所創薬デザイン研究センターの笠原勇矢副センター長との共同研究で、肺がん等のがん細胞にその役割が不明ながら多く発現するカルシウム透過型TRPC3/C6チャネルに着目し、これを選択的に活性化する化合物L687の取得に成功しました。
様々なASOとL687を共に種々のがん細胞に添加したところ、ASOはがん細胞内に効率よく取り込まれ、ASOが標的とする遺伝子の発現を大きく抑制することを見出しました。ASOとL687を担がんマウスの腫瘍内に投与した実験でも同様の効果が認められました。
加えて、L687によるASOの細胞内取り込みの亢進にはTRPC3/C6チャネルを介した細胞内へのカルシウムの流入が必須であり、それにより、がん細胞が細胞外物質を飲食する作用を誘導することが示唆されました。結果として、細胞外のASOが細胞内に取り込まれることになります。
研究成果は、国際科学誌Nucleic Acids Researchに、2024年4月16日午前0時5分 (協定世界時)/4月16日午前9時5分(日本時間) にオンライン版で発表されました。
[画像1: https://prtimes.jp/i/118477/35/resize/d118477-35-6b95f9804d8ad3e4ba7b-0.jpg ]
概念図. TRPC3/C6チャネルの活性化によるASOの細胞内取り込み増強
研究の背景
アンチセンス核酸医薬やsiRNAなどの核酸医薬は、低分子医薬や抗体医薬とは異なり、タンパク質の発現を遺伝子レベルで制御することから、次世代の分子標的医薬として注目されています。遺伝子発現の調節によって疾患関連タンパク質の生成を制御するという機能を有することから、様々ながん疾患にも応用できる可能性があります。しかしながら、核酸医薬は、一般の医薬品と比べて分子量が大きく親水性であり、細胞表面の脂質の膜となじみにくく、その結果、細胞内に移行する割合が極めて低くなっています。そのため、せっかくの核酸医薬の機能が細胞内で十分に発揮されず、その汎用性は大きく制限されていました。核酸医薬をがん治療に応用するためには、核酸医薬のがん細胞内移行性を高める技術の開発が喫緊の課題となっていました。
TRP (Transient Receptor Potential) チャネルはカルシウムをはじめとする無機陽イオンを透過する細胞膜に存在するタンパク質であり、遺伝子の相同性から6つのサブファミリーに分かれ合計28種類のサブタイプが知られています。それらのうち、トウガラシ成分のカプサイシンによって活性化し、温度センサーとしても機能するTRPVファミリーに属するTRPV1チャネルが2021年のノーベル生理学・医学賞の対象になったことは記憶に新しいと思います。TRPチャネルは医薬品の標的としては未だ道半ばであり、TRPチャネルを直接活性化または阻害する医薬品はこれまで上市されていません。我々の研究グループでは、TRPチャネルのサブタイプTRPC3/C6チャネルに着目し、医薬品の創成を目指して研究開発を続けており、最近、新たにTRPC3/C6チャネルを選択的に活性化することができる化合物の合成に成功し、L687と名付けました。
我々は研究の過程から、L687がTRPC3/C6チャネルを介してカルシウムを細胞内へ流入させることにより、核酸医薬の細胞内取り込みを促進させるのではないかという仮説を立て、実験を開始しました。
研究の内容
本研究グループは、まずTRPC3/C6チャネルが高発現している肺がん由来細胞A549の培地に蛍光標識ASOとL687を混合して添加し、48時間後にHoechst溶液(細胞核を染色するために用いる溶液)によって染色を行い、蛍光顕微鏡による画像解析を行いました。イメージングではASOは赤色、生細胞の核は青色で示されており、L687存在下で細胞内蛍光標識ASO量が増加していることが示されました(図1)。
[画像2: https://prtimes.jp/i/118477/35/resize/d118477-35-3407fe9ba5a4141a534a-1.jpg ]
図1. TRPC3/C6活性化剤L687存在下での細胞イメージング
A549細胞にAlexa-647 ASO (100 nM) とL687 (30 µM) を添加し、48時間後に生細胞の核をHoechst溶液で染色し、蛍光顕微鏡を用いて撮影を行った。核は青色、ASOは赤色で表示されている。
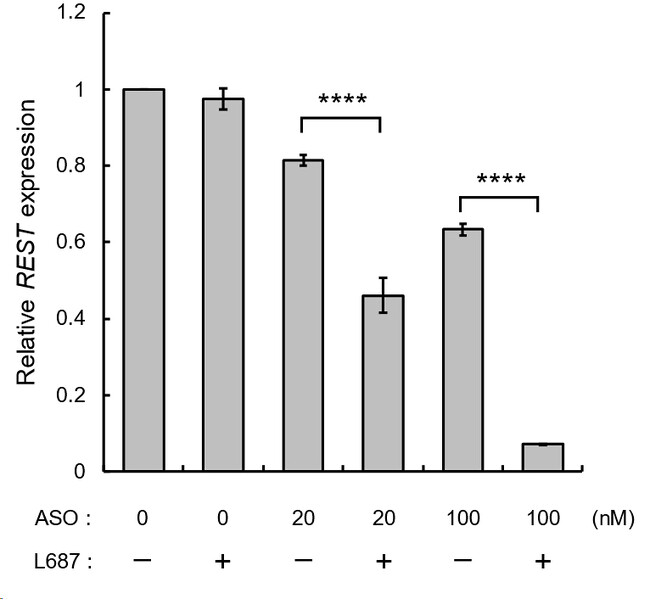
A549細胞ではがん発症に関わっていると考えられるREST (RE1-silencing transcription factor) 遺伝子が高発現しています。ASOの取り込み評価で用いたA549細胞に対してREST標的ASOとL687を添加し、REST遺伝子発現量を解析しました。A549細胞にREST標的ASO (20, 100 nM) とL687 (30 µM) を添加し72時間後、同様にREST遺伝子の発現量をRT-qPCRにより解析したところ、L687の添加によりREST遺伝子の発現量が顕著に減少しました。これはL687により細胞内に取り込まれるREST標的ASO量が5倍以上に増加し、REST遺伝子の発現抑制活性が向上したためと考えられました(図2)。
[画像3: https://prtimes.jp/i/118477/35/resize/d118477-35-1621d4be34af1f9ca4f7-2.jpg ]
図2. REST標的ASOとL687存在下でのREST発現量評価
A549細胞にREST標的ASO (20, 100 nM) とL687 (30 µM) を添加し、72時間後に回収した細胞からtotal RNAを抽出し、RT-qPCRによるREST発現解析を実施した。内部標準にはGAPDHを用い、未処理細胞での発現量を基準としたΔΔCt法によりREST発現量を算出した (n=3、平均値±SEM)。各群の平均値をTukey検定により解析した (****p < 0.0001)。
小細胞肺がん由来N417細胞を皮下移植して作成した担がんマウスに対し、SRRM4 (Serine/Arginine repetitive matrix 4) 標的ASOを用いた腫瘍内投与実験を行いました。SRRM4は小細胞肺がん及び治療抵抗性前立腺がんに異常発現しており、その発現抑制は担がんマウスにおいて抗腫瘍効果を示すことからSRRM4 標的ASOの開発が進められています (ResOU 2019-6-19●生命科学・医学系、【引用情報】 参照)。SRRM4 標的ASO投与前にあらかじめL687 (1.5 µg) を腫瘍内投与しておき、1日後にSRRM4 標的ASO (10 µg) とL687 (1.5 µg) を混合して腫瘍内投与し、さらに1日後に腫瘍を摘出しました。腫瘍細胞へのASOの移行量は、ASO配列特異的定量法ELOSA (enzyme-linked oligosorbent assay) にて解析し、並びにSRRM4遺伝子の発現抑制効果はRT-qPCRにて評価しました (図3A)。腫瘍内細胞に蓄積したSRRM4 標的ASO量を算出したところ、SRRM4 標的ASO + 溶媒のみの群 (0.46 µg) と比較してSRRM4 標的ASO + L687群 (1.28 µg) では、SRRM4 標的ASO移行量が2.78倍に増加しました(図3B)。その後、RNA抽出を行い、RT-qPCRによりSRRM4遺伝子の発現量を解析したところ、SRRM4 標的ASO + 溶媒のみの群に比べてSRRM4 標的ASO + L687群ではSRRM4遺伝子の発現量が約40%減少していました (図3C)。L687とASOの併用はin vivoにおいても有効であることが示唆されました。
[画像4: https://prtimes.jp/i/118477/35/resize/d118477-35-7f3054648e704e075754-3.jpg ]
図3A. 小細胞肺がんを移植したマウス腫瘍内投与の実験方法
N417細胞 (5.0×105 cells) をBALB/c Slc-nu/nu 7週齢のマウスの左腰部に対して皮下移植し、3~4週間後にASOとL687の投与を開始した。最終投与日の次の日をエンドポイントとした。
図3B. ELOSAによる腫瘍内ASO量評価
N417担がんマウスを用いた抗腫瘍効果評価におけるエンドポイントにて採取した腫瘍に対して、 臓器全体のASO移行量をELOSAにより評価した (n=5, 平均値±SEM)。各群の平均値をt検定により解析した (**p < 0.01)。
図3C. 腫瘍内SRRM4発現量解析
腫瘍の一部を切り出し、total RNAを抽出後、RT-qPCRによる解析を実施した。内部標準にはGAPDHを用い、ASO + DMSO群の腫瘍における発現量を基準としたΔΔCt法によりSRRM4発現量を算出した (n=3, 平均値±SEM)。各群の平均値はt検定により解析した (**p < 0.01)。
本研究成果が社会に与える影響(本研究成果の意義)
本研究では、アンチセンス核酸ASOとTRPC3/C6チャネル活性化剤L687を併用することで、in vitro(試験管内での試験)とin vivo(生体内での試験)の両方でASOの細胞内取り込みが促進され、標的遺伝子の発現抑制活性が向上することを見出しました。これまでの核酸医薬は、その適応範囲が肝臓に発現する遺伝子を標的とするものか、局所投与を余儀なくされるものに限定されており、特にがん疾患を適応症とする核酸医薬で市場販売の開始に至ったものはありませんでした。本研究成果により、がん疾患を適応症とする核酸医薬の開発が大きく進展するものと期待しています。
特記事項
研究成果は、国際科学誌Nucleic Acids Researchに、2024年4月16日午前0時5分 (協定世界時)/4月16日午前9時5分(日本時間) にオンライン版で発表されました。
タイトル:“A novel transient receptor potential C3/C6 selective activator induces the cellular uptake of antisense oligonucleotides.”
著者名:Hiroto Kohashi, Ryu Nagata, Yusuke Tamenori, Tomorrow Amatani, Yoshifumi Ueda, Yasuo Mori, Yuuya Kasahara, Satoshi Obika and Masahito Shimojo
DOI:https://doi.org/10.1093/nar/gkae245
なお、本研究は、日本医療研究開発機構(AMED)「先端的バイオ創薬等基盤技術開発事業」、「創薬等先端技術支援基盤プラットフォーム(BINDS)」などの支援のもとで行われました。
【引用情報】
難治性肺がん治療に大きな前進となる新しい核酸医薬を開発!
https://resou.osaka-u.ac.jp/ja/research/2019/20190619_1
Shimojo M, Kasahara Y, Inoue M, Tsunoda SI, Shudo Y, Kurata T, Obika S. A gapmer antisense oligonucleotide targeting SRRM4 is a novel therapeutic medicine for lung cancer. Sci Rep 9, 7618 (2019). https://doi.org/10.1038/s41598-019-43100-1
Yoshida M, Oda C, Mishima K, Tsuji I, Obika S, Shimojo M. An antisense amido-bridged nucleic acid gapmer oligonucleotide targeting SRRM4 alters REST splicing and exhibits anti-tumor effects in small cell lung cancer and prostate cancer cells. Cancer Cell Int 23, 8 (2023). https://doi.org/10.1186/s12935-022-02842-1
用語説明
※1 アンチセンス核酸医薬 (ASO)
標的とするRNA (mRNA、pre-mRNA、microRNAなど) に対して相補的な塩基配列を有する人工合成した核酸分子であり、標的RNAに結合して機能の制御を行う。既存の低分子医薬や抗体医薬では標的にすることが難しい細胞内のRNAを直接標的にすることが可能であり、次世代の医薬品として注目されている。
※2 核酸医薬
一般に核酸あるいは人工核酸が十数~数十塩基からなるオリゴ核酸で構成され、通常化学合成により製造される。アンチセンス核酸医薬(ASO)、2本鎖のオリゴ核酸からなり標的RNAを触媒的に切断する機能を持つsiRNA、細胞表面に発現する抗原タンパク質と結合しその機能制御を担うアプタマー、免疫賦活作用を持つCpGオリゴなどが代表例であり、近年、その臨床開発及び実用化が大きく進んでいる。
※3 TRPC3/C6チャネル
TRP (Transient Receptor Potential) チャネルのサブタイプ。TRPは、脂質膜に発現し、6回膜貫通型TRPタンパク質群のホモあるいはヘテロ4量体からなる多様な陽イオンチャネルである。TRPチャネルの活性化と開口は、温度変化、pHの変化、機械刺激、内在性や外界の天然化学物質などによって惹起され、多くが高いNa+及びCa2+透過性を示す。様々な組織にTRPチャネルは分布する。
【小比賀教授のコメント】
本研究では、アンチセンス核酸ASOとTRPC3/C6チャネル活性化剤L687を併用することで、in vitroとin vivoの両方でASOの細胞内取り込みが促進され、標的遺伝子の発現抑制活性が向上することを見出しました。本研究成果により、がん疾患を適応症とする核酸医薬の開発が大きく進展するものと期待しています。
SDGs目標
[画像5: https://prtimes.jp/i/118477/35/resize/d118477-35-7db3056112a180f0cc3d-4.jpg ]
参考URL
薬学研究科 生物有機化学分野HP
http://www.phs.osaka-u.ac.jp/homepage/b007/index.html
[画像6: https://prtimes.jp/i/118477/35/resize/d118477-35-8c885f8fa983c3ede951-5.jpg ]
企業プレスリリース詳細へ
PR TIMESトップへ
この記事に関連するニュース
-
【東京医科大学】がん細胞をはじめとする種々のエクソソーム分泌の新たな機序解明 ~ 乳がんなどのがん転移阻害剤の開発に貢献する可能性 ~
Digital PR Platform / 2024年7月24日 20時5分
-
【大阪大学】大学院医学系研究科が住友ゴム工業株式会社との共同研究を開始 ― 個々のがん患者にあった治療薬を届けるコンパ二オン診断を目指して
Digital PR Platform / 2024年7月23日 14時5分
-
CD4-CD8-ダブルネガティブT細胞が大腸がんを攻撃する免疫を抑えている?
PR TIMES / 2024年7月5日 11時45分
-
パーキンソン病患者に特異的な皮脂RNA情報の同定に成功
PR TIMES / 2024年6月28日 13時15分
-
パーキンソン病患者に特異的な皮脂RNA情報の同定に成功
PR TIMES / 2024年6月28日 12時45分
ランキング
-
1〈最低賃金1054円に〉過去最大増なのにパート、アルバイトから大ブーイングのワケ「扶養控除ライン据え置きはオフサイドトラップ」「政治家の報酬だけは世界トップクラスだけど、賃金はオーストラリアの半分」
集英社オンライン / 2024年7月26日 18時56分
-
2赤字続きのミニストップ、逆転を狙う新業態は「コンビニキラー」? まいばすけっとに続けるか
ITmedia ビジネスオンライン / 2024年7月26日 6時15分
-
3土用丑のうなぎで嘔吐=京急百貨店
時事通信 / 2024年7月26日 19時32分
-
4「ジェネリックにしますか?」と薬局で聞かれましたが、「新薬」にしました。これって損ですか…?
ファイナンシャルフィールド / 2024年7月26日 8時40分
-
5タワマンで迷子、自分の部屋に帰れない…年金月25万円の69歳父が母と肩を寄せ合い暮らす「子供部屋」に唖然【FPの助言】
THE GOLD ONLINE(ゴールドオンライン) / 2024年7月26日 11時45分
記事ミッション中・・・
記事にリアクションする
![]()
記事ミッション中・・・
記事にリアクションする

エラーが発生しました
ページを再読み込みして
ください











