脳内炎症と統合失調症とをつなぐ新たな分子を発見
PR TIMES / 2024年10月26日 22時40分
未だ根本的な治療法の存在しない統合失調症の原因を解明する新たなモデルマウスとして期待
〈今回の発見のポイント〉
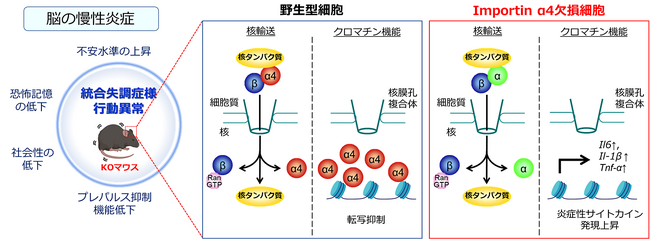
国立研究開発法人医薬基盤・健康・栄養研究所(大阪府茨木市 理事長 中村祐輔) 創薬デザイン研究センター生体機能分子制御プロジェクトの宮本洋一主任研究員は、細胞核輸送ダイナミクスプロジェクトの岡正啓プロジェクトリーダー(現大阪大学微生物病研究所 講師)、大阪大学蛋白質研究所の櫻井航輝助教(現エアランゲン大学)/疋田貴俊教授らのグループ、並びに大阪大学大学院薬学研究科、福井大学大学院医学研究科、Hudson Institute of Medical Research (オーストラリア)との共同で、核輸送分子Importin α4※1(遺伝子名Kpna4)が、脳内炎症や精神疾患様の行動異常発症に関連を持つ分子であることを発見しました。
この研究では、㋐Importin α4遺伝子ノックアウト(KO)マウスが、不安水準の上昇、社会性の低下、プレパルス抑制※2障害といったヒトの統合失調症※3と類似した行動異常を示すことを見出しました。また、㋑その行動異常の原因を探索した結果、Importin α4が本来持つ核輸送機能ではなく、遺伝子発現を制御するクロマチン※4制御能の不全が炎症性サイトカインの発現を亢進し、脳の炎症を高めることを発見しました。本研究は、Importin α4が「脳内炎症」と「統合失調症」とをつなぐ重要な機能分子である可能性を示した世界で最初の報告となります。本研究で開発されたマウスは、統合失調症が示す複雑な分子メカニズムを解明するモデルマウスとして、今はまだ根本的な治療法が存在しない統合失調症の疾患治療薬開発等に活用されることが期待されます。
[画像1: https://prcdn.freetls.fastly.net/release_image/118477/59/118477-59-16bb22102283c3e77e51625313861559-1411x519.png?width=536&quality=85%2C75&format=jpeg&auto=webp&fit=bounds&bg-color=fff ]
本研究成果は2024年10月8日に「Translational Psychiatry」に発表されました。
ウェブサイト:https://doi.org/10.1038/s41398-024-03138-w
研究の概要
〈はじめに〉
統合失調症は、幻覚、妄想、意欲の低下、認知機能障害等、感情や思考と行動のコントロールがうまくできないこころの病気です。およそ100人に1人弱の割合で発症し、根本的な治療法が存在しないことから、生涯にわたる薬物治療や長期入院等発症者への重い負担が問題となっています。発症の原因については、遺伝的要因と環境要因の両方が寄与することが分かっています。特に近年、脳や全身の炎症状態が発症に関与する可能性が挙げられているものの、炎症反応と統合失調症とをつなぐ分子メカニズムについてはほとんど明らかになっていませんでした。
今回、細胞質に存在するタンパク質を細胞核に輸送する分子として知られるImportin α4 (遺伝子名Kpna4)の全身欠損が、マウスにおいて統合失調症様の行動異常を引き起こすことを発見しました。Importin α4タンパクは、ヒトで7種類、マウスで6種類存在するImportin αファミリーの内の一つで、様々な核タンパク質の輸送を担っています。また、近年はタンパク質輸送だけでなく、細胞核に存在するクロマチンと相互作用して遺伝子発現を制御する機能を持つ等、多機能分子としての側面があることも分かってきています。
〈Importin α4の欠損が引き起こす行動異常〉
本研究では、Importin α4の機能がマウスの行動異常に関与するかどうかを調べる目的で、遺伝子ノックアウト(KO)マウスを用いた行動解析実験を行いました。その結果、Importin α4 KO(欠損)マウスでは1.不安水準の上昇, 2.恐怖記憶の低下, 3.社会性の低下, 4.プレパルス抑制(大きな音を連続して聴いた時に後の音に対する反応が抑制される現象)の低下等、ヒトの統合失調症でみられる症状に類似した行動異常を示すことを見出しました。また、KOマウスの脳組織を複数の領域に分けて採取し、遺伝子の発現を調べた結果、Tnf-α、Il-1β、Il-6といった炎症性サイトカイン遺伝子の発現が上昇傾向にあり、特に前頭葉や扁桃体においては有意に発現上昇していることを見出しました。
〈A:Importin α4の核輸送機能が脳炎症を抑制しているかどうかの検証〉
これら炎症性サイトカインの遺伝子発現は、シグナル伝達分子NF-κB※5によって制御されることが知られています。また、 NF-κBファミリー分子の一つであるp65(RelA)分子は、Importin α4によって核へ輸送されることが知られていることから、KOマウスから分離培養した脳細胞(初代培養アストロサイト)におけるp65分子の細胞内局在を調べました。
その結果、野生型細胞と同様にImportin α4欠損細胞においても、TNF-α刺激に依存してp65分子は核に輸送されました(図1A)。このことは、Importin α4欠損脳細胞では、他のImportin αファミリー分子がImportin α4に代わってp65を核へと輸送していることを意味していると考えられます。実際、Importin α4によって輸送されることが分かっている代表的な核タンパク質の局在を検証したところ、検証したすべてのタンパク質がKO細胞において核に局在していることを確認しました。このことから、たとえImportin α4を欠損したとしても、他のImportin α分子が機能補完することで核輸送機構全体を正常に保っていることを示しています。
一方で、p65分子が核に局在した際の集積度は、野生型細胞と比べてKO細胞の方が有意に高いことが分かりました(図1B)。さらに、p65分子の下流遺伝子であるIl-6やIl-1βの発現もKO細胞において有意に上昇していることから(図1C)、Importinα4の核輸送機能とは異なる機能の不全が脳内炎症を亢進することが示唆されました。
[画像2: https://prcdn.freetls.fastly.net/release_image/118477/59/118477-59-2dfa1385f55b6cab4803cbbe9bde43ae-1550x567.png?width=536&quality=85%2C75&format=jpeg&auto=webp&fit=bounds&bg-color=fff ]
〈B:Importin α4のクロマチン制御能が脳炎症を抑制しているかどうかの検証〉
これまでの知見として、Importin α4は核輸送だけでなくクロマチン制御能を通して遺伝子発現を制御しうることが知られています。これらのことから、Importin α4欠損による炎症サイトカインの発現上昇は、クロマチン機能によって担われていることが予想されました。そこで、それを検証するために遺伝子レスキュー実験(具体的内容:KOマウスから樹立したマウス線維芽細胞(MEF)に、Importin α4の全長遺伝子、及びImportin β結合(Importin β binding: IBB)領域を欠いた核輸送不全変異体(ΔIBB)遺伝子を強制発現させ、再び炎症性サイトカインの発現を抑制するかどうか検証)を行いました。その結果、Importin α4全長遺伝子と同様、ΔIBB変異体遺伝子を発現した細胞でもそれぞれ炎症性サイトカインの発現が抑制されることが分かりました。このことから、Importin α4は核輸送機能よりむしろクロマチン制御能を発揮することで炎症性サイトカインの発現制御を行っていることを示唆する結果が得られました。
[画像3: https://prcdn.freetls.fastly.net/release_image/118477/59/118477-59-011bc5d8ca6182e5e196dea93d86faa6-1217x470.png?width=536&quality=85%2C75&format=jpeg&auto=webp&fit=bounds&bg-color=fff ]
〈C:Importin α4の欠損がどのように脳炎症を引き起こすかの検証〉
最後に、Importin α4の欠損によって、脳内の炎症反応及び炎症性サイトカインの分泌に関与するグリア細胞(ミクログリア、アストロサイト)の遺伝子発現にどのような影響があるかを検証しました。KOマウスの脳組織からグリア細胞を選択的に回収し、細胞の遺伝子発現を網羅的に定量可能な「RNAseq法」を使うことで、どのような遺伝子が変化しているかを調べました(図2A)。さらに、「RNAseq法」により得られた遺伝子発現パターンに基づいて、「発現が変化した遺伝子を制御している転写制御因子」を、「エンリッチメント解析」(図2B)や「wPGSA解析※6」(図2C)という手法により探索しました。その結果、KOマウス由来のグリア細胞において、発現が減少した遺伝子の多くが、「Polycomb repressor complex 2 (PRC2)※7」という転写を抑制するタンパク質群が制御する対象であり、この遺伝子発現パターンはPRC2による転写抑制の増加によるものであると予測されました。PRC2の増加によりグリア細胞(ミクログリア)が炎症反応を起こすという報告が存在することから、Importin α4の欠損は、グリア細胞におけるPRC2複合体の遺伝子発現抑制能を増加させ、それによる遺伝子発現の異常がKOマウスの脳内炎症や行動異常につながっているということを示唆する結果が得られました。
以上のように、本研究では、行動制御や脳細胞の恒常性維持にImportin α4が重要な役割を担っていることを明らかにしました。このImportin α4 KOマウスは、統合失調症と脳内炎症との関係性を探索するモデル動物として、未だ根本的な治療法がない統合失調症の新たな治療薬開発等への活用が期待されます。
研究支援
本研究成果は、日本学術振興会(JSPS)科学研究費補助金(JP15K07068, JP20K06455, JP22KK0111, 16H04789, JP22H02944, JP23K18163, 17H03679, 20H03444, 23K27373)、国立研究開発法人日本医療研究開発機構(AMED)「脳とこころの研究推進プログラム(精神・神経疾患メカニズム解明プロジェクト)」(JP21wm0425010)、「革新的先端研究開発支援事業」 (JP21gm1510006)、「創薬等先端技術支援基盤プラットフォーム」(JP23ama121052, JP23ama121054)、科学技術振興機構(JST)次世代研究者挑戦的研究プログラム(JPMJSP2138)等の支援のもとで実施されました。
論文情報
論文タイトル:Importin α4 deficiency induces psychiatric disorder-related behavioral deficits and neuroinflammation in mice.
著者:櫻井航輝1,2, 森田真規子1,3, 青峰良淳1, 松本光史4,5, 盛山哲嗣6, 笠原恵美子4, 関山敦生4, 大谷真弓8, 大島里詠子8, Kate L. Loveland 10, 山田雅已6,7, 米田悦啓11, 岡正啓8,12*, 疋田貴俊1,3*, 宮本洋一8,9*
1. 大阪大学蛋白質研究所高次脳機能学研究室
2. 大阪大学蛋白質研究所機能・発現プロテオミクス研究室
3. 京都大学大学院医学研究科メディカルイノベーションセンター
4. 大阪大学大学院薬学研究科先制心身医薬学寄附講座
5. ミルテニーバイオテク株式会社
6. 福井大学医学部医学科分子生体情報学分野
7. 福井大学ライフサイエンスイノベーションセンター
8. 国立研究開発法人医薬基盤・健康・栄養研究所細胞核輸送ダイナミクスプロジェクト
9. 国立研究開発法人医薬基盤・健康・栄養研究所生体機能分子制御プロジェクト
10. Centre for Reproductive Health, Hudson Institute of Medical Research
11. 一般財団法人阪大微生物病研究会
12. 大阪大学微生物病研究所感染腫瘍制御分野
*責任著者
掲載雑誌: Translational Psychiatry
用語解説
※1 Importin α:
塩基性アミノ酸によって構成される核局在化シグナル(Nuclear localization signal: NLS)の受容体で、輸送担体Importin β1と協調して核タンパク質の細胞質から核への輸送を担うタンパク質分子。ヒトで7種類、マウスで6種類のサブタイプが存在し、それぞれが異なる基質特異性を持つことで様々な核タンパク質の選別輸送に機能する。また、核輸送だけでなく、紡錘体形成、核膜重合、タンパク質分解、クロマチン制御による遺伝子発現制御等様々な機能を発揮する多機能分子としても知られる。
※2 プレパルス抑制:
強い聴覚刺激の直前に弱い聴覚刺激(プレパルス)を与えると、強い聴覚刺激に対する驚愕反応が大幅に抑制される現象のことで、脳内の感覚運動情報処理を反映する。統合失調症ではプレパルス抑制の障害が報告されている。
※3 統合失調症:
健常な状態では見られない症状が出現する「陽性症状」(例:幻覚、妄想等)と、健常な状態では可能なことができなくなる「陰性症状」(例:意欲の低下、抑うつ等)が見られる精神疾患。主に10~20代で発症が見られ、発症率は幅広い人口集団(さまざまな国における多数の調査)で共通して約100人に1人であることが知られている。根本的な治療法が存在しないことから、重症例では長期にわたる入院につながる。日本国内の精神科病棟における入院の原因として長年第1位である。
※4 クロマチン:
真核生物の細胞核に存在する、DNAとヒストンタンパク質からなる複合体。4種類のヒストンタンパクが2個ずつ集まった8量体の周りにDNAが巻き付いたヌクレオソームと呼ばれる構造が多数集まることで数メートルにも及ぶDNA分子を細胞核の中に格納することができる。ヒストンタンパク質がさまざまな化学的修飾を受けることにより、特定の遺伝子の発現が変化することが知られている。
※5 NF-κB:
RelA/p65、RelB、c-Rel、NF-κB1/p50、及びNF-κB2/p52の5種類が知られており、これらがホモダイマーあるいはヘテロダイマーを形成して転写因子として機能する。最も一般的なシグナル伝達経路として、p50 と p65 から形成されるヘテロダイマーであり、TNF-α、IL-1β、リポポリサッカライド(LPS)等によって刺激されると、阻害因子IκBが外れることでImportin αと結合し核へと輸送されて転写機能を発揮する。
※6 weighted parametric gene set analysis (wPGSA):
遺伝子発現パターンのデータを用い、その遺伝子発現パターンに寄与する転写因子を予測する手法。2016年に川上らにより開発された(出典: Kawakami, et al., 2016, Nucleic Acids Research)
※7 Polycomb repressor complex 2 (PRC2):
主にSuz12、 Eed、Ezh1/2、Rbbp4を含むタンパク質複合体で、ヒストンにH3K27me3という化学修飾を付加する。これにより遺伝子発現を抑制する事が知られ、細胞の分化や個体の発生において重要な役割を果たすことが分かっている。
医薬基盤・健康・栄養研究所について
2015年4月1日に医薬基盤研究所と国立健康・栄養研究所が統合し、設立されました。本研究所は、メディカルからヘルスサイエンスまでの幅広い研究を特⾧としており、我が国における科学技術の水準の向上を通じた国民経済の健全な発展その他の公益に資するため、研究開発の最大限の成果を確保することを目的とした国立研究開発法人として位置づけられています。
ウェブサイト:https://www.nibiohn.go.jp/
[画像4: https://prcdn.freetls.fastly.net/release_image/118477/59/118477-59-2dbe6b91d3a4a50ae98121f053172feb-1074x377.png?width=536&quality=85%2C75&format=jpeg&auto=webp&fit=bounds&bg-color=fff ]
企業プレスリリース詳細へ
PR TIMESトップへ
この記事に関連するニュース
-
精神的ストレスがアトピー性皮膚炎を悪化させるメカニズムを解明
PR TIMES / 2024年12月23日 14時0分
-
抗炎症免疫応答に寄与するRALDH2の発現を促す食品由来物質を同定 ~免疫疾患の新たな予防法開発につながる成果~
PR TIMES / 2024年12月16日 11時45分
-
加齢性疾患の予防・進行抑制に向け、予防医学の新たな可能性 FPP(パパイヤ発酵食品)によるNrf2の活性化について発表
@Press / 2024年12月13日 10時0分
-
タウリンは炎症に伴う免疫細胞へのダメージを軽減する
@Press / 2024年12月10日 11時0分
-
タウリンは炎症に伴う免疫細胞へのダメージを軽減する
Digital PR Platform / 2024年12月10日 11時0分
ランキング
-
1東大志望の彼「クリスマスに筆箱」でキレた深い訳 親御さんに知ってほしい「受験生へのNG行動」
東洋経済オンライン / 2024年12月24日 7時50分
-
2船の浸水隠しから“最悪の結末” JR九州「日韓航路」から撤退へ 異形の新造船「クイーンビートル」はどうなる?
乗りものニュース / 2024年12月24日 7時12分
-
3ラーメン店が回転率を犠牲にしてでも「麺の硬さ」を選ばせるワケ
ITmedia ビジネスオンライン / 2024年12月23日 8時10分
-
4「さい銭箱にスマホ決済」で参拝風景が変わる将来 金融庁が「電子マネーの利用解禁」に向け準備中
東洋経済オンライン / 2024年12月24日 8時0分
-
5フリーランスに求められるスキル 2位は「スマートフォン・モバイル制作」、1位は?
ITmedia ビジネスオンライン / 2024年12月23日 17時15分
記事ミッション中・・・
記事にリアクションする
![]()
記事ミッション中・・・
記事にリアクションする

エラーが発生しました
ページを再読み込みして
ください











