6種類の機能を持つD-アミノ酸代謝酵素を初期の生命から発見--北里大学
Digital PR Platform / 2024年12月23日 14時5分
北里大学薬学部分析化学教室の宮本哲也講師、東京大学大学院農学生命科学研究科の伏信進矢教授らの研究グループは、共通の祖先に近い生物である超好熱菌Thermotoga maritimaから異なる6種類の機能を持つ多機能型アミノ酸代謝酵素を発見しました。この多機能型酵素は、D-アミノ酸及びL-アミノ酸の両方を代謝できることを明らかにしました。さらに、酵素の立体構造及び反応メカニズムを明らかにしました。この研究成果は、2024年12月11日付で、米国化学会の学術誌「ACS Catalysis」に掲載されました。
■研究成果のポイント
・初期の生命である超好熱菌から多機能型アミノ酸代謝酵素TM1270を発見しました。
・多機能型アミノ酸代謝酵素TM1270は、異なる6種類の機能を有する前例のない酵素であることを明らかにしました。
・多機能型アミノ酸代謝酵素TM1270は、D-アミノ酸及びL-アミノ酸の両方を代謝できることを明らかにしました。
・多機能型アミノ酸代謝酵素TM1270の立体構造を明らかにしました。
・多機能型アミノ酸代謝酵素TM1270が持つ異なる6種類の機能の反応メカニズムを明らかにしました。
■研究の背景
アミノ酸には、L型とその鏡像異性体であるD型が存在します。生命は基本的にL-アミノ酸のみを使って、タンパク質を作りますが、分析技術の発展に後押しされて、D-アミノ酸も様々な生物種に存在していることが確認されたことで、各生物にD-アミノ酸を積極的に利用するシステムが備わっていると考えられています。細菌において、D-アミノ酸は細胞壁のペプチドグリカンや抗生物質の構成成分に利用されています。哺乳類ではD-アミノ酸を合成する酵素は一つしか知られていませんが、細菌は様々なD-アミノ酸合成酵素を有しており、それらの酵素によって細胞壁の合成に必要なD-アミノ酸を作っています。細胞壁のD-アミノ酸を合成する酵素は薬剤のターゲットとなり、近年では、細菌のバイオフィルムがD-アミノ酸の存在下で解体されることや腸内細菌が合成するD-アミノ酸が宿主の病態や健康に影響を与えることが明らかとなり、医学・薬学的観点からも注目されています。しかしながら、多種多様な細菌に存在する多様なD-アミノ酸代謝酵素に関する知見は、まだまだ不十分です。
■研究内容と成果
本研究では、共通の祖先に近い生物である、超好熱菌Thermotoga maritimaを対象にD-アミノ酸代謝酵素を探索しました。我々の研究グループでは、以前大腸菌から多機能型アミノ酸代謝酵素 (シスタチオニン b-リアーゼ) を発見しており (参考文献1)、その知見に基づいてThermotoga maritimaのTM1270という酵素に注目しました。TM1270は、ラセマーゼ活性、bC-Sリアーゼ活性、デヒドラターゼ活性、アルドラーゼ活性、デカルボキシラーゼ活性、アミノトランスフェラーゼ活性の異なる6種類の活性をいずれも効率良く触媒することを明らかにしました 【表1】。ラセマーゼ活性とは、L-アミノ酸とD-アミノ酸を相互に変換する活性、すなわち、L-アミノ酸からD-アミノ酸を合成する活性です。TM1270は、14種類のアミノ酸に対してラセマーゼ活性を示し、その中でグルタミン酸に対して最も活性が高いことが明らかになりました。また、我々の研究グループは、過去の研究でTM1270が細胞壁の構成成分の一つであるD-グルタミン酸の合成に寄与していることを明らかにしています (参考文献2)。bC-Sリアーゼ活性とは、システインなどに含まれる炭素-硫黄結合を切断する活性で、システインはピルビン酸、硫化水素、アンモニアへと分解されます。TM1270は、L型とD型両方のシステインとL-シスタチオニンを分解する活性を有することを明らかにしました。デヒドラターゼ活性とは、セリンなどヒドロキシ基 (-OH) を含むアミノ酸を分解する活性で、セリンはピルビン酸とアンモニアに分解されます。TM1270は、L型とD型の両方のセリン及びL-allo-スレオニンに対してデヒドラターゼ活性を示すことが明らかとなりました。アルドラーゼ活性とは、炭素-炭素結合を切断する活性で、例えば、スレオニンをグリシンとアセトアルデヒドに分解する活性です。TM1270は、L-スレオニンとL-allo-スレオニンに対してアルドラーゼ活性を示すことがわかりました。デカルボキシラーゼ活性とは、カルボキシ基 (-COOH) を持つアミノ酸に対して作用し、二酸化炭素を脱離させる活性です。TM1270は、L-アスパラギン酸をL-アラニンと二酸化炭素に分解する活性を有することを明らかにしました。アミノトランスフェラーゼ活性は、アミノ酸のアミノ基 (-NH2) を2-オキソ酸へと転移させ、別のアミノ酸を合成する活性です。TM1270は、16種類のL-アミノ酸及び7種類の2-オキソ酸に対してアミノトランスフェラーゼ活性を示すことが明らかになりました。以上の解析結果から、TM1270は非常に多くのD-アミノ酸及びL-アミノ酸を代謝することができる前例のないアミノ酸代謝酵素であることが明らかとなりました。
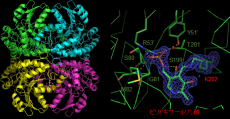
また、TM1270の立体構造をX線結晶構造解析により明らかにしました 【図1】。TM1270は4量体であり、分子内に補酵素となるピリドキサールリン酸が結合していました。このピリドキサールリン酸は、TM1270が有する6種類の多様な反応を触媒するのに欠かせない化合物です。TM1270の立体構造と他の生物が持つTM1270と類似した酵素の立体構造を比較することで、TM1270において多機能性に関わる重要なアミノ酸残基を推定しました。また、それらのアミノ酸残基を別の種類のアミノ酸に置換した変異酵素を作製し、各種の酵素活性への影響を解析することにより、多機能性に関わるアミノ酸残基を特定しました。さらに、TM1270の立体構造及び変異酵素の機能解析の結果を総合することで、6種類の酵素活性における原子レベルでの反応機構を推定することに成功しました。
-
-
- 1
- 2
-

この記事に関連するニュース
-
高塩分と低塩分のイカ塩辛の製造過程における代謝産物と細菌群の変化を解明〜伝統的水産発酵食品の風味の特徴を科学的に分析〜--北里大学
Digital PR Platform / 2024年12月25日 20時5分
-
SyntheticGestalt、アサヒクオリティーアンドイノベーションズ、東京科学大学の三者がAI技術を活用した次世代PETボトル分解技術を共同開発
PR TIMES / 2024年12月20日 8時0分
-
大麦摂取による血糖値上昇抑制のメカニズムが明らかに腸内のコハク酸が血糖値に及ぼす影響について解析
PR TIMES / 2024年12月10日 11時0分
-
大腸菌L-formにおいて、隔壁合成はアメーバ様細胞から一定の大きさの球形細胞への変化に必要である〜進化の過程で細胞形態がどのように決められたかの考察〜
Digital PR Platform / 2024年12月5日 14時5分
-
血管の若返りや免疫力UPも「みそ汁」のスゴイ効果 肝臓専門医が解説「具材に何を入れるかがミソ」
東洋経済オンライン / 2024年11月30日 7時0分
ランキング
-
112月末まで!今年の「ふるさと納税」注意したい点 定額減税の影響は? 申し込む前に要チェック
東洋経済オンライン / 2024年12月26日 13時0分
-
2「プライドが高い日産」に手を焼くホンダの未来が見える…深刻な経営危機に陥った「国内2位メーカー」の根深い問題
プレジデントオンライン / 2024年12月26日 10時15分
-
312月に大掃除をする人は「なぜお金が貯まらないのか」を片付けのプロが丁寧解説
プレジデントオンライン / 2024年12月26日 9時15分
-
4焦点:日産との統合、ホンダから漏れる本音 幾重のハードル
ロイター / 2024年12月26日 14時46分
-
5日本郵便とヤマト「120億円訴訟」に至った言い分 物流サービスの「大同団結」が危うい事態に
東洋経済オンライン / 2024年12月26日 7時30分
複数ページをまたぐ記事です
記事の最終ページでミッション達成してください










