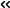抗菌薬耐性酵素が変異を重ねて高度耐性の表現型を獲得する 巧みな分子メカニズムを原子レベルで解明
Digital PR Platform / 2024年1月10日 10時39分
研究手法・研究成果
研究グループはまずCMY-185の有する各変異が「セフタジジムの分解」と「アビバクタムによる阻害の回避」のどちらに寄与するのかを調べるため、変異の組み合わせが異なる7種類の酵素を調製して(変異無し:CMY-2、1変異体:V211S、N346Y、2変異体:A114E_N346Y、Q120K_N346Y、V211S_N346Y、4変異体:CMY-185)、実際に薬が分解される速度や阻害の強度を調査しました。その結果、V211S変異はセフタジジム分解効率を向上させることがわかりました。加えて、N346Y変異が導入された酵素はアビバクタム阻害活性が1/1,000に弱まり、N346Y変異にA114E変異やQ120K変異が加わるとそれぞれ阻害活性が1/2,000、1/10,000とさらに減弱されることがわかりました。また、アビバクタム阻害活性の減弱は、アビバクタムが酵素へ結合しにくくなったことが要因であることも突き止めました。
次に、視覚的にCMY-185がセフタジジムを分解する様子を観察するため、CMY-185の結晶を調製し、茨城県つくば市にある高エネルギー加速器研究機構の放射光実験施設Photon Factory BL-17Aビームラインを利用してX線結晶構造解析法による立体構造の決定を行いました(図1)。その結果、CMY-185の立体構造はCMY-2の立体構造と全体的にはよく似ているものの(図1左下)、N346Y変異の導入によって、薬が結合する部位が局所的に狭くなっていることがわかりました(図1中上)。しかし、ここにセフタジジムが結合すると、変異したY346残基側鎖の回転が生じると共に、H-10ヘリックスと呼ばれる部位の構造崩壊が起こり(図1右下)、CMY-2より薬の結合する部位が広がっている様子が観察されました(図1右上)。過去に報告されたβ-ラクタマーゼとセフタジジム及びアビバクタムの結合様式に関する研究結果も踏まえて考察すると、アビバクタムは、酵素のN346残基を含む周辺のアミノ酸によって、アビバクタム分子の硫酸基側が重点的に認識されます。そのため、CMY-185のようにN346Y変異が導入されると、この重点的な認識機構が崩れたことが致命傷となってアビバクタムが結合できなくなっていることが想定されました。一方で、セフタジジムは、酵素が分子全体を認識して結合させているため、結合の邪魔になるN346Y変異が導入されたとしても他のアミノ酸との相互作用の方が勝り、Y346残基の方が回転によってセフタジジムとの衝突を回避し、その結果H-10ヘリックス構造の崩壊が起こり、より薬が結合する部位が広がったものと推測されました。
さらに実験的に決定したCMY-185とセフタジジム複合体の立体構造を初期モデルとして、分子動力学シミュレーションによって分子の動きを観察したところ、残り3つの変異(A114E、Q120K、V211S)の導入によって、CMY-2では存在しない分子内相互作用が安定的に形成されることが示唆されました。そして、A114E変異は分子内部の相互作用が増強し酵素の剛体化が進むことで全般的な酵素活性が減弱し、Q120K変異は従来アビバクタムの認識に関与していたQ120残基の変異による相互作用喪失に加えて、アミノ酸自体が基質結合部位の方へ向かない形で固定されることで、よりアビバクタムが結合できないようになっていることが示唆されました。また、V211S変異の導入によって、分解された後のセフタジジム分子の動きが激しくなっている様子が観察され、これによって酵素から分解されたセフタジジムが離脱しやすくなり、次から次へとセフタジジム分解酵素反応のサイクルが回るようになったことが想定されました。
この記事に関連するニュース
-
抗ヒスタミン薬Doxepinの異性体による結合特性のちがいを解明 ~次世代抗ヒスタミン剤の設計へ向けた新たな知見~
PR TIMES / 2024年7月1日 14時45分
-
【名城大学・北海道大学】インプラント周囲炎に対する光応答性ナノ複合体を開発~インプラント周囲炎の新しい治療法への応用に期待~
Digital PR Platform / 2024年6月26日 20時5分
-
【名城大学・北海道大学】インプラント周囲炎に対する光応答性ナノ複合体を開発
@Press / 2024年6月26日 18時0分
-
武蔵野大など、爪における水虫(白癬菌)の増殖を抑制できる阻害剤を発見
マイナビニュース / 2024年6月17日 17時27分
-
肺がん治療の今(3)分子標的薬と免疫チェックポイント阻害剤で攻撃
日刊ゲンダイ ヘルスケア / 2024年6月13日 9時26分
ランキング
-
1小田急線「都会にある秘境駅」が利用者数の最下位から脱出!超巨大ターミナルから「わずか700m」
乗りものニュース / 2024年7月1日 14時42分
-
220年ぶりの新紙幣に期待と困惑 “完全キャッシュレス”に移行の店舗も
日テレNEWS NNN / 2024年7月2日 22時4分
-
3メルカリの「単発バイトアプリ」利用者伸ばす世相 「何が利点なのか」利用者と店舗の声を聞いた
東洋経済オンライン / 2024年7月3日 13時30分
-
4ローソン、7月24日上場廃止 KDDIとポイント経済圏の拡大などを目指す
ITmedia ビジネスオンライン / 2024年7月3日 17時46分
-
5「新札ゲットできました」新紙幣求め銀行やATMに行列 導入の狙いは「偽造防止の強化」と「使いやすさ向上」 1万円札は渋沢栄一 5000円札は津田梅子 1000円札は北里柴三郎
TBS NEWS DIG Powered by JNN / 2024年7月3日 12時8分
複数ページをまたぐ記事です
記事の最終ページでミッション達成してください