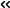ワニはどうして長時間水に潜れるのか?
Digital PR Platform / 2024年8月7日 14時54分
研究内容
研究グループは、North Texas大学にて生態学の実験目的で飼育されているワニ (Alligator mississippiensis) から採取された血液からヘモグロビンを精製して、クライオ電子顕微鏡による構造解析を行いました。それにより、酸素が結合した状態、一酸化炭素 (CO) が結合した状態(図1a)、および酸素が解離した状態(デオキシ状態)(図1b)の3種類の状態の立体構造を明らかにすることに成功しました。デオキシ状態のヘモグロビン試料は、大阪大学栗栖研究室に設置された嫌気チャンバー内の低酸素環境下で調製しました。
[画像1]https://digitalpr.jp/simg/1706/92954/500_267_2024080612212666b196b695d47.jpg
図1 a) 一酸化炭素 (CO) が結合した状態のR型構造をとったワニのヘモグロビンの電顕マップ。b) デオキシ状態のT型構造をとったワニのヘモグロビンの電顕マップ。α1サブユニットをピンク色、β1サブユニットを水色、α2サブユニットを黄緑色、β2サブユニットをオレンジ色、ヘムを黄色で表示している。
・重炭酸イオンとの結合様式
2.2オングストローム(Å、1Åは100億分の1メートル)の高分解能で決定した、T型構造をとったデオキシ状態のワニのヘモグロビンの立体構造から、ヘモグロビン4量体のαサブユニット、βサブユニットの界面に合計2分子の重炭酸イオンが結合することが明らかになりました(図2a)。その結合部位は、他の脊椎動物のヘモグロビンにおける有機リン酸の結合部位とは異なっており、ワニのヘモグロビンが独自に獲得したものであることがわかりました。重炭酸イオンは合計8つのアミノ酸によって認識されており(図2b、c)、ヒトを含む他の動物のヘモグロビンと比較すると、ワニでは特に2つのアミノ酸置換(βサブユニットの38番目のスレオニン*3と、41番目のフェニルアラニン*4)が重炭酸イオンによる作用を獲得するために重要であることが明らかになりました(図2d)。
[画像2]https://digitalpr.jp/simg/1706/92954/500_302_2024080612215266b196d07adf3.jpg
図2 a) 重炭酸イオン(黄色)が結合したT型構造のワニのヘモグロビンの立体構造。b) 重炭酸イオンの電顕マップの密度。c) 重炭酸イオンとT型構造のワニのヘモグロビンのβ1サブユニット(水色)との結合様式。d) ワニのヘモグロビン(水色)とヒトのヘモグロビン(オレンジ色)における重炭酸イオン結合部位の比較。
この記事に関連するニュース
-
バンコマイシン耐性腸球菌(VRE)感染症の治療に道-ナトリウムポンプ阻害剤の発見とその阻害機構を解明-
PR TIMES / 2024年11月25日 15時15分
-
珪藻光化学系Iフコキサンチンクロロフィル結合タンパク質超複合体の立体構造解析を基盤とするタンパク質間相互作用の解明〔静岡大学, 岡山大学 ,京都大学〕
PR TIMES / 2024年11月12日 0時3分
-
珪藻光化学系Iフコキサンチンクロロフィル結合タンパク質超複合体の立体構造解析を基盤とするタンパク質間相互作用の解明
PR TIMES / 2024年11月8日 5時45分
-
【名城大学】スイゼンジノリ由来の紫外線吸収物質「サクリピン」の新たなスキンケア作用を発見
@Press / 2024年11月6日 15時0分
-
抗がん剤開発に関するプロジェクトが科学技術振興機構(JST)2024年度ディープテック・スタートアップ国際展開プログラム(D-Global)に採択
PR TIMES / 2024年11月5日 22時40分
ランキング
-
1コーヒー豆が歴史的高騰、NY市場で最高値…産地のブラジルやベトナムで不作
読売新聞 / 2024年11月29日 0時0分
-
2ダイハツ 軽トラ「ハイゼット トラック ローダンプ」約5千台リコール届け出
ABCニュース / 2024年11月28日 15時44分
-
3読売333、資産運用立国を推進へ…「指数市場は活性化する」
読売新聞 / 2024年11月28日 21時41分
-
4為替相場 29日(日本時間 8時)
共同通信 / 2024年11月29日 8時0分
-
5「トイレ流せない…」水道代にも値上げの波 千葉で水道代を2割“値上げ”方針 住民からは悲鳴も【Nスタ解説】
TBS NEWS DIG Powered by JNN / 2024年11月25日 21時9分
複数ページをまたぐ記事です
記事の最終ページでミッション達成してください