群大など、ホタルの生物発光メカニズムの完全解明に向けて一歩前進
マイナビニュース / 2024年4月15日 20時1分
群馬大学(群大)、高エネルギー加速器研究機構(KEK)、分子科学研究所(分子研)、総合研究大学院大学(総研大)、静岡大学の5者は4月12日、炭素原子のX線吸収の計測および理論計算による分析を通じて、ホタル生物発光の発光色に大きく関わる「ホタルルシフェリン」(以下、「ルシフェリン」と省略)のフェノール性水酸基からの脱プロトン化がpHの変化により生じる様子を明らかにすることに成功したと共同で発表した。
同成果は、群大大学院 理工学府の工藤優斗大学院生、同・樋山みやび准教授、同・板橋英之教授、KEK 物質構造科学研究所の熊木文俊博士研究員、同・足立純一講師、分子研の長坂将成助教(総研大兼任)、静岡大の野口良史准教授、名古屋大学の古賀伸明名誉教授らの共同研究チームによるもの。詳細は、米国化学会が刊行する分子・イオン・ラジカルなどに関する全般を扱う学術誌「The Journal of Physical Chemistry A」に掲載された。
ホタルの生物発光は、実はまだ完全解明には至っていない。基本的には、基質であるルシフェリンと「ルシフェラーゼ酵素」とのルシフェリン-ルシフェラーゼ反応による発光であることはわかっている。同反応の経路としては、まずルシフェリンと、細胞内のエネルギーの通貨と呼ばれる「アデノシン三リン酸」(ATP)が、中間体である「ルシフェリル-AMP」を生成。次いで、酸化反応により発光体である「ホタルオキシルシフェリン」の励起状態が生成されるモデルが認められている。しかし同モデルでは、pH(水素イオン指数)や温度などの環境の違いによって、発光色が異なるという理由を説明できないことが課題だった。
その課題を解決するには、酵素や溶媒の存在下で発光反応途中の構造変化を調べる必要があるという。しかし、この環境を考慮した分子構造の変化は実験的に捉えることが難しく、発光色が決まる分子的なレベルでのメカニズムは依然として解明できていなかった。そこで研究チームは今回、溶媒のpH変化によってルシフェリンからプロトン(陽子=水素イオン)が脱離する時に起こる分子構造の変化を、「炭素原子X線吸収スペクトル」の変化として捉えることを目指すことにしたとする。
プロトンの離脱は、環境の変化でルシフェリンが示す構造変化のモデルケースだという。今回の研究では、分子構造の変化を捉える方法として、物質の特定原子周辺の化学状態を観測できるX線吸収計測、中でも有機分子の基礎となる炭素原子の内殻励起を利用する、炭素原子X線吸収計測が着目された。
-
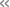
-
- 1
- 2
-

この記事に関連するニュース
-
宇宙誕生の138億年前から1秒もずれない「原子核時計」実現に一歩前進、日本人が活躍する「次世代型時計」開発の意義
ニューズウィーク日本版 / 2024年4月24日 14時50分
-
早大、超高屈折率と透明性の両立に加え使用後は分解するプラスチックを開発
マイナビニュース / 2024年4月23日 12時18分
-
ガラスがより硬く割れにくい材料に変化する初期過程をNIMSとJASRIが観測
マイナビニュース / 2024年4月22日 17時24分
-
タンパク質の動きを3Dで見る!創薬を加速する0.5フェムト秒の挑戦
ASCII.jp / 2024年4月18日 11時0分
-
物質最薄の一次元分子ポリマーランダムネットワークの創出!~新たな触媒・分子マシン・人工知能・量子材料開発へ~
PR TIMES / 2024年4月5日 12時40分
ランキング
-
1ヤマト運輸の「偽サイト」が話題 今までより質向上?
おたくま経済新聞 / 2024年5月1日 11時32分
-
2ドコモオンラインショップ、「iPhone 15 128GB」が4.4万円引きなどの「GWセール」を5月7日で終了
ITmedia Mobile / 2024年5月1日 17時21分
-
3パッと見で分からない細かいこだわりも バッファロー開発陣に聞くWi-Fi 7ルーター「WXR18000BE10P」の秘密【後編】
ITmedia PC USER / 2024年5月1日 15時5分
-
4こんなにかわいい手作りサラダ、初めて見た!! 460万再生突破の簡単レシピに「こ、これは天才!」「よく思い付きましたね」
ねとらぼ / 2024年5月1日 9時30分
-
5ジョージア大使、松屋にポーランド風ハンバーグ登場で心配「国際情勢に影響しかねない熾烈な戦いになりそう」
iza(イザ!) / 2024年5月1日 13時55分
複数ページをまたぐ記事です
記事の最終ページでミッション達成してください










