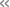抗菌薬耐性酵素が変異を重ねて高度耐性の表現型を獲得する 巧みな分子メカニズムを原子レベルで解明
Digital PR Platform / 2024年1月10日 10時39分
藤田医科大学 医学部 微生物学講座 河合 聡人 講師、土井 洋平 教授、米国MDアンダーソンがんセンター William C. Shropshire 博士、Samuel A. Shelburne教授らの国際共同研究グループは、多剤耐性グラム陰性細菌による感染症治療に用いられるセフタジジム(第3世代セファロスポリン)–アビバクタム(β-ラクタマーゼ阻害剤)合剤で治療中の患者から、この合剤に高度耐性を示す大腸菌を単離し、その原因がCMY-2 β-ラクタマーゼの4アミノ酸変異体 CMY-185であることを突き止めていました。そして、今回、このCMY-185がアビバクタムの結合を拒絶しながら、セフタジジムの分解活性を保持する巧みな酵素の分子メカニズムを原子レベルで解明しました。
本研究成果は、1月5日に米国微生物学会が出版している学術ジャーナル「mBio」のオンラインへ掲載されました。
論文URL : https://doi.org/10.1128/mbio.02874-23
研究成果のポイント
セフタジジム–アビバクタム合剤で治療中の患者から単離された大腸菌が有したβ-ラクタマーゼCMY-2の4アミノ酸変異体(A114E、Q120K、V211S、N346Y)であるCMY-185の薬剤耐性メカニズムを研究。
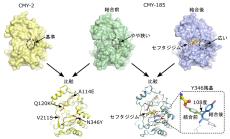
X線結晶構造解析、分子動力学計算、酵素速度論解析により、CMY-185が有するN346Y変異がセフタジジムとアビバクタムを識別するセンサーとして働き、残り3つの変異が協調してセフタジジムの分解能を有したままアビバクタムの結合を拒否する分子メカニズムを原子レベルで解明。
背景
抗菌薬が効かない薬剤耐性病原性細菌の蔓延は世界的な問題で、WHO(世界保健機関)も公衆衛生上最大の脅威の1つとして対策を講じています。抗菌薬は感染症治療の切り札ですが、これらを多用することで強い抗菌薬にも抵抗性を持つ細菌だけが生き残ってしまい、その細菌が増殖して世の中がどの抗菌薬も効かない薬剤耐性細菌だらけになることが危惧されています。そこで、世界的に「抗菌薬の適正使用」が優先課題となり、今日の細菌感染症治療では、原因となっている細菌を特定し、その細菌に適切な抗菌薬を最適な量と日数で治療を行うことが今まで以上に求められています。
研究グループは、米国MDアンダーソンがんセンターに入院していた術後感染症治療中の患者で、起因菌を調べ、その段階で適切な抗菌薬を選択し治療したにも関わらず、すぐに薬剤耐性の大腸菌が出現し、再度最適な抗菌薬の選択と変更を行ってもその薬が効かない大腸菌が次々と採取された症例を報告しました(Shropshire WC et al., High-level ceftazidime/avibactam resistance inEscherichia coliconferred by the novel plasmid-mediated β-lactamase CMY-185 variant. J Antimicrob Chemother. 78(10):2442–2450. 2023 doi: 10.1093/jac/dkad249)。この報告では、薬剤耐性傾向が特に強いグラム陰性細菌による感染症治療に使用されるセフタジジム–アビバクタム合剤にも耐性を示した大腸菌のゲノム解析により、CMY-185と命名された新たなβ-ラクタマーゼを産生していることがわかりました。CMY-185は、これまでに報告のあったβ-ラクタマーゼCMY-2のアミノ酸配列と比較して4カ所のアミノ酸変異(A114E、Q120K、V211S、N346Y)を有する酵素です。そして、N346Y変異を主軸に他の変異が重なることでセフタジジム–アビバクタム合剤への耐性度が高くなっていくことを実験的に確かめました。しかし、これらの変異がセフタジジム–アビバクタム合剤への耐性にどのように関与しているのかについては謎のままでした。
この記事に関連するニュース
-
抗ヒスタミン薬Doxepinの異性体による結合特性のちがいを解明 ~次世代抗ヒスタミン剤の設計へ向けた新たな知見~
PR TIMES / 2024年7月1日 14時45分
-
【名城大学・北海道大学】インプラント周囲炎に対する光応答性ナノ複合体を開発~インプラント周囲炎の新しい治療法への応用に期待~
Digital PR Platform / 2024年6月26日 20時5分
-
【名城大学・北海道大学】インプラント周囲炎に対する光応答性ナノ複合体を開発
@Press / 2024年6月26日 18時0分
-
武蔵野大など、爪における水虫(白癬菌)の増殖を抑制できる阻害剤を発見
マイナビニュース / 2024年6月17日 17時27分
-
肺がん治療の今(3)分子標的薬と免疫チェックポイント阻害剤で攻撃
日刊ゲンダイ ヘルスケア / 2024年6月13日 9時26分
ランキング
-
120年ぶりの新紙幣に期待と困惑 “完全キャッシュレス”に移行の店舗も
日テレNEWS NNN / 2024年7月2日 22時4分
-
2小田急線「都会にある秘境駅」が利用者数の最下位から脱出!超巨大ターミナルから「わずか700m」
乗りものニュース / 2024年7月1日 14時42分
-
3メルカリの「単発バイトアプリ」利用者伸ばす世相 「何が利点なのか」利用者と店舗の声を聞いた
東洋経済オンライン / 2024年7月3日 13時30分
-
4「新札ゲットできました」新紙幣求め銀行やATMに行列 導入の狙いは「偽造防止の強化」と「使いやすさ向上」 1万円札は渋沢栄一 5000円札は津田梅子 1000円札は北里柴三郎
TBS NEWS DIG Powered by JNN / 2024年7月3日 12時8分
-
5「7月3日の新紙幣発行」で消費活動に一部支障も? 新紙幣関連の詐欺・トラブルにも要注意
東洋経済オンライン / 2024年7月2日 8時30分
複数ページをまたぐ記事です
記事の最終ページでミッション達成してください