世界初、「クロウ・深瀬(POEMS)症候群」の治療薬としてサリドマイドが承認されました
PR TIMES / 2021年3月29日 19時15分
血清VEGFの体外診断薬も承認され、難病に苦しむ全国の患者さんの早期診断、治療が可能に
千葉大学病院(病院長横手幸太郎)は、医師主導治験「サリドマイド(商品名:サレド(R)カプセル25・50・100)のクロウ・深瀬(POEMS)症候群に対する臨床試験」に全国12施設共同(代表拠点:当院)で取り組み、その成果として、サリドマイドの製造販売元である藤本製薬株式会社(代表取締役社長藤本雅也)によって薬事申請がなされ、2021年2月24日、サリドマイドが治療薬として承認されました。また、本疾患は血管内皮増殖因子(以下、VEGF)値の上昇が認められるものの、これまでVEGF測定試薬は研究用のみであったため、同社は、血清VEGF測定用体外診断用医薬品(商品名:VEGF ELISAキット「フジモト」)を開発・薬事申請し、承認されました。いずれも産学連携の成果と言えます。
[画像1: https://prtimes.jp/i/15177/476/resize/d15177-476-288569-0.png ]
クロウ・深瀬症候群は、末梢神経、胸腹水・浮腫、腎不全など多臓器を障害する難治疾患です。日本人に多いとされ、全国患者数は約400名で、そのうち100例以上を当院で診ています。平均発症年齢は約50歳で、若年から中年に多く、手足の高度な麻痺と多臓器不全により、適切な治療が行われない場合の平均生存期間は33ヶ月とされる重篤な疾患です。急速に進行、重症化することが多く、治療法の確立が急がれていましたが、患者の少なさゆえに治療薬開発は困難とされてきました。本研究により、適切かつ迅速な診断・治療への道が開かれました。
【 用語説明 】
※1 VEGF:正常な血管ではタンパク質はほとんど通過しないが、病的血管においては、タンパク質などの高分子物質も透過する状態となり、透過性亢進状態となっている。その主な原因は高濃度のVEGF-Aによるとされており、透過性亢進状態になることで、様々な症状が発生する。
研究責任者 桑原聡教授(脳神経内科長)のコメント
治療薬としての有効性を示すためには、実薬と偽薬(プラセボ)を無作為に割り付け、医師・患者ともどちらを服用しているかを知らされない「二重盲検プラセボ対照ランダム化比較試験」が必要です。今回、本疾患では世界で初めてこの試験を行いました。今後、本疾患の治療の選択肢が大きく広がることを期待しています。
研究の背景
[画像2: https://prtimes.jp/i/15177/476/resize/d15177-476-351529-1.png ]
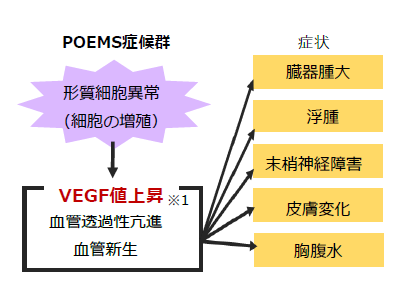
クロウ・深瀬症候群(別名:POEMS症候群)は、多発性骨髄腫の類縁疾患であり、 形質細胞の異常増殖と、VEGFの異常高値を基盤に、多発神経炎による末梢神経障害(脱髄性ニューロパチー)、臓器腫大(肝脾腫)、内分泌異常、Mタンパク血症、皮膚症状(剛毛、色素沈着、血管腫)などを呈する全身性疾患です。特に末梢神経障害が患者の日常生活動作を著しく障害し、末期には四肢麻痺、多臓器不全に至る予後不良の疾患であり、平成27年1月1日施行の指定難病に指定(指定難病16)されています。2015年から2016年にかけて行われた最新の全国調査では推定患者数は392人であり、有病率は人口10万人あたり0.3人と推定されています。多発性骨髄腫の治療法を応用し、ステロイド治療、自己末梢血幹細胞移植を伴う大量化学療法、サリドマイド療法などの治療の試みがなされていますが、標準的な治療法は確立されておらず、国内・海外ともに既承認薬はありません。そこで、本研究グループは、千葉大学病院を代表機関として、サリドマイドのクロウ・深瀬症候群に対する医師主導治験を実施しました。サリドマイドは昭和30年代に深刻な薬害が相次ぎ、国内では40年以上販売が禁止されていましたが、再び12年前に承認され、多発性骨髄腫等の治療に使われています。当院では全国の患者約400例のうち、100例以上を診療しています。
また、本症候群では、血清中のVEGF値が健康人や他疾患に比べて異常高値を示します。国内外の診断基準及び指定難病において、大基準として「血清VEGF上昇(1,000pg/mL)以上」が規定されています。しかし、現在VEGF測定は国内での保険適用はなく、VEGF測定試薬は研究用試薬のみであり、薬機法による製造販売承認が得られている体外診断用医薬品や医療機器はありません。そのため、体外診断用医薬品の開発に着手しました。
研究の概要
(1) サリドマイド(商品名:サレドカプセル)
1. 国内第II/III相試験(自己末梢血幹細胞移植非適応患者)1)2)
自己末梢血幹細胞移植の適応とならないクロウ・深瀬(POEMS)症候群患者24例に、本剤(隔日100mg~1日200mg)又はプラセボをデキサメタゾン併用注)下で24週間(6サイクル)投与した二重盲検比較試験期において、本剤群の血清VEGF減少率はプラセボ群と比較して有意に高く、本剤によるデキサメタゾンへの上乗せ効果が認められた。また、徒手筋力試験の合計スコアにおいて本剤群に改善が認められた。
[画像3: https://prtimes.jp/i/15177/476/resize/d15177-476-293123-2.png ]
また、二重盲検比較試験期から移行した患者23例に本剤(隔日100mg~1日300mg)を48週間(12サイクル)投与した長期試験期において、血清VEGF減少率(平均値±標準偏差[95%信頼区間](例数))はサイクル1終了時が0.0441±0.27362[-0.08044、0.16866](21例)で、サイクル4終了時は0.0635±0.48305[-0.16934、0.29631](19例)、サイクル8終了時は0.2848±0.36547[0.07375、0.49578](14例)と減少率は上昇した。その後も減少率は維持し、終了時の減少率は0.2782±0.40101[0.04666、0.50974](14例)であり、長期投与による血清VEGF値の改善が確認された。
二重盲検比較試験期および長期試験期を通じて本剤を投与された25例中23例(92.0%)において副作用が認められ、主な副作用は便秘(60.0%)、洞性徐脈(44.0%)、末梢性感覚ニューロパチー(20.0%)であった。臨床検査値の異常変動は10例(40.0%)に認められた。洞性徐脈は100mg隔日投与(25例)で5例(20.0%)、100mg連日投与(24例)で2例(8.3%)、200mg連日投与(24例)で4例(16.7%)認められた。また、心不全が200mg連日投与で1例(4.2%)、プリンツメタル狭心症、失神、洞停止が300mg連日投与(7例)で各1例(14.3%)認められた。そのうち重篤な事象は200mgの心不全1例、300mgのプリンツメタル狭心症、洞停止の各1例であった。
2. 国内第II相試験(自己末梢血幹細胞移植適応患者)2)
クロウ・深瀬(POEMS)症候群患者に、大量化学療法を伴う自己末梢血幹細胞移植療法の前治療として本剤(隔日100mg~1日300mg)、デキサメタゾン(20mg/日、1-2サイクル:2~5、16~19日目、3-6サイクル:2~5日目)を24週間(6サイクル)投与した国内臨床試験において、本剤が投与された10例における24週後の血清VEGF減少率は0.69±0.33(平均値±標準偏差)、中央値は0.85(範囲:0.0-1.0)であり、血清VEGF値の改善が認められた。本剤を投与された10例中10例(100%)において副作用が認められ、主な副作用は便秘(90.0%)、洞性徐脈(50.0%)であった。臨床検査値の異常変動は2例(20.0%)に認められた。洞性徐脈は100mg隔日投与(10例)で2例(20.0%)、100mg連日投与(10例)で2例(20.0%)、200mg連日投与(9例)で1例(11.1%)認められた。
(2) VEGF 測定試薬(商品名:VEGF ELISAキット「フジモト」)3)
本品は血清中VEGF値をELISA(酵素免疫測定法)により測定するキットです。
医師主導治験に参加したクロウ・深瀬症候群患者29例の血清141検体を用い、本品と臨床現場で汎用されている本品と同一測定法(ELISA法)であるA社製品(研究用試薬)との相関性を検討した結果、良好な相関が得られました(図1)。
また、本品を用いたPOEMS症候群の診断のカットオフ値を、POEMS症候群患者及び健康成人の血清中VEGF値を基にしたROC曲線解析により算出しました。その結果、指定難病で示されている診断基準値1,000 pg/mLにおいて、高い感度(100%)、特異性(100%)を示しました(図2)。
[画像4: https://prtimes.jp/i/15177/476/resize/d15177-476-811409-3.png ]
今後の展望
この結果を受けて、世界初サリドマイドのクロウ・深瀬症候群に対する効能・効果追加が薬事承認され、治療に新たな選択肢を広げることができました。また、血清VEGF測定も可能となり、診断及び治療モニタリングに有用です。千葉大学病院及び藤本製薬株式会社は、この経験を活かし、今後も難病治療の発展を目指し、新規治療開発に取り組んでいく所存です。
特記事項
国内第II/III相試験(自己末梢血幹細胞移植非適応患者)は、厚生労働科学研究(医療技術実用化総合研究事業(臨床研究・治験推進研究事業))の「医師主導治験の実施支援並びに我が国の治験推進に関する研究」として実施し、公益社団法人日本医師会の支援によって行われました。
参考資料
(1) Misawa S.: Lancet Neurol. 2016 Oct;15(11):1129-37(PMID: 27496680)
(2)サレドカプセル 添付文書(2021年2月改訂 第2版、効能変更)
(3)VEGF ELISAキット「フジモト」(2021年3月作成 第1版)
用語説明
【サリドマイド】
1959年に睡眠薬・安定剤として発売された薬剤だが、妊婦が服用した場合に催奇性が問題となり、販売中止になっていた。その後、VEGFなどの蛋白の産生を抑制する作用が認められ、再び製造されるようになった。
【二重盲検プラセボ対照ランダム化比較試験】
実薬と偽薬(プラセボ)を無作為に割り付け(ランダム化)、医師・患者ともどちらを服用しているかを知らされない(二重盲検)臨床試験。本研究では世界で初めてPOEMS症候群でこの試験を行い、サリドマイド療法は形質細胞の増殖とVEGFの産生を抑制することを証明した。
【ELISA(酵素免疫測定法)】
ELISA(Enzyme-linked immunosorbent assay)は,抗原抗体反応により分析対象物を検出する免疫学的測定法の一つで、検出用試薬として酵素標識体を利用する方法である。
測定原理:
抗体固相化マイクロプレートに検体を添加することで、血清中のVEGFと抗体固相化マイクロプレートに固相化された固相抗体(抗ヒトVEGF抗体(ラット)(モノクローナル抗体))が抗原抗体反応により固相抗体-VEGFの複合体を形成される(一次反応)。洗浄
後、標識抗体(HRP標識抗ヒトVEGF抗体(ウサギ)(ポリクローナル抗体))を添加することで固相抗体-VEGF-標識抗体の複合体が形成される(二次反応)。再度洗浄後、TMB基質液を加えることで、複合体の西洋ワサビペルオキシダーゼ(HRP)に基質(3,3’,5,5’-テトラメチルベンチジン)が反応し、発色する。停止液にて反応停止後、この発色の吸光度を測定することにより、血清中VEGF値が求められる。
企業プレスリリース詳細へ
PR TIMESトップへ
この記事に関連するニュース
-
治療選択肢が増えた短腸症候群に関する臨床疑問を解決する、診療科を横断した「短腸症候群/腸管不全」専門医チームが発足
PR TIMES / 2024年4月26日 18時40分
-
ポリマー結合型の新規抗がん剤を研究開発
Digital PR Platform / 2024年4月8日 11時30分
-
オレキシン受容体拮抗剤「ボルノレキサント水和物」の不眠症患者様を対象とした第Ⅲ相臨床試験結果のお知らせ
@Press / 2024年4月3日 11時0分
-
オレキシン受容体拮抗剤「ボルノレキサント水和物」の不眠症患者様を対象とした第Ⅲ相臨床試験結果のお知らせ
Digital PR Platform / 2024年4月3日 11時0分
-
感染が相次ぐ麻疹(はしか)とは? 感染リスクが高い「ワクチン空白世代」は要注意
ウェザーニュース / 2024年3月31日 5時10分
ランキング
-
1米ファンドに日本KFC売却=三菱商事、来月にも
時事通信 / 2024年4月26日 20時17分
-
2円安、物価上昇通じて賃金に波及するリスクに警戒感=植田日銀総裁
ロイター / 2024年4月26日 18時5分
-
3突然現場に現れて「良案」を言い出す上司の弊害 「気になったら即座に直したい」欲求への抗い方
東洋経済オンライン / 2024年4月26日 9時0分
-
4「加賀屋」50歳の元若女将が選んだ"第2の人生" 震災からの復興への道、仕事術について聞く
東洋経済オンライン / 2024年4月26日 13時0分
-
5なぜ歯磨き粉はミント味? ヒット商品の誕生には「無駄」が必要なワケ
ITmedia ビジネスオンライン / 2024年4月26日 8時0分
記事ミッション中・・・
記事にリアクションする
![]()
記事ミッション中・・・
記事にリアクションする

エラーが発生しました
ページを再読み込みして
ください










