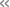プラス電荷を失ったリシン側鎖がつくる新規な水素結合の発見- リシンについて教科書の常識を見直す。新たな分子間相互作用から創薬へ -
Digital PR Platform / 2024年8月27日 14時5分
概要
東京薬科大学薬学部の三島正規教授、青山洋史准教授、武田光広講師、永江峰幸助教、大阪大学蛋白質研究所の宮ノ入洋平准教授、豊橋技術科学大学の広瀬侑准教授らの研究グループは、東京大学先端科学技術研究センターの石北央教授(同大学院工学系研究科兼務)、斉藤圭亮准教授、野地智康特任助教、東京都立大学大学院理学系研究科の伊藤隆教授、甲斐荘正恒名誉教授と共同で、核磁気共鳴法(NMR)(注1)やタンパク質の量子化学計算(注2)などを用いて、通常はプラス電荷を帯びると考えられているリシンの側鎖が、シアノバクテリアの光センサータンパク質の中でプラス電荷を失った状態で安定に存在すること、さらに水素結合のアクセプターとして働き、今まで知られていなかった様式の水素結合を形成していることを発見しました。リシンの側鎖がプラス電荷を帯びることは高校・大学で学習する生化学の常識です。この常識について再考を促すとともに、タンパク質の立体構造形成メカニズムの解明、タンパク質と薬などの相互作用メカニズムの解明に役立つことが期待されます。
本研究成果のポイント
・NMRや計算化学の手法を用いて、タンパク質中でリシン側鎖のアミノ基が通常のN+H3(電荷を持つプロトン化状態)(注3)ではなく、NH2(電荷を持たない脱プロトン化状態)で存在し、水素結合を形成していることを発見しました。
・さらにこの水素結合では、リシン側鎖のNH2が水素結合のアクセプターとなっていました。よく知られているN+H3の場合では水素結合のドナーとなっていることから、通常とは逆です。
・今回発見した、リシンがアクセプターとしてはたらく様式の水素結合は、従来の膨大なタンパク質の立体構造研究の中で見過ごされてきた可能性があります。今回の発見は、タンパク質の立体構造形成や、薬をはじめとした多様なリガンド分子とタンパク質との相互作用の理解を深めることに貢献し、薬の開発にも役立ちます。
Ⅰ.研究の背景
水素結合は、タンパク質中において、立体構造形成、タンパク質とリガンドの結合、プロトン移動など、非常に重要な役割を果たしています。水素結合におけるドナー(供与体)と、水素結合におけるアクセプター(受容体)、そして水素原子で形成され(図1)、pKa値(注4)が高い部位(例:塩基性の官能基)がドナーとして、pKa値が低い部位(例:酸性の官能基)がアクセプターとなります(図1)。タンパク質においては、通常、リシンやアルギニンの側鎖は(注5)、プロトン化されてプラス電荷を持つことからドナーとなるとされてきました。シアノバクテリアのRcaEは、ピロール環を4つ含むフィコシアノビリン(PCB)分子を発色団として有する光センサータンパク質です。特定の波長を吸収することで緑色光吸収型と赤色光吸収型の間を変換し、それぞれ異なる立体構造を形成することが知られていました(1)(2)(3)。今回、NMRとタンパク質の量子化学計算によって、緑色光吸収型においてRcaE内部のリシンの側鎖のアミノ基が脱プロトン化してプラス電荷を失ったNH2となること、またこのNH2が水素結合のアクセプターとなり、PCBがもつNH基がドナーとなる水素結合を形成していることを明らかにしました(図2)。従来、リシン側鎖の脱プロトン化は、アセトアセテートデカルボキシラーゼや、Exiguobacterium sibiricumロドプシンで起こることが石北、斉藤らによって計算化学によって示されていましたが(4)(5)、脱プロトン化し、かつ水素結合のアクセプターとなることが実験で示されたのは、これが初めてです。
この記事に関連するニュース
-
無機化合物の結晶構造を計算コストかけず網羅的に探索、経験則を不等式で表すのがミソ 東大
マイナビニュース / 2024年11月28日 19時20分
-
世界初!ナノファブリック型新規高機能性白金電極触媒の開発に成功
PR TIMES / 2024年11月28日 17時15分
-
デロイト トーマツが、創薬分野での量子コンピュータ実用化時期の見極めと早期化に向けて実証を開始、新薬開発の知見を有する中外製薬と連携
Digital PR Platform / 2024年11月19日 14時52分
-
珪藻光化学系Iフコキサンチンクロロフィル結合タンパク質超複合体の立体構造解析を基盤とするタンパク質間相互作用の解明
PR TIMES / 2024年11月8日 5時45分
-
【名城大学・HPCシステムズ株式会社】分析困難な有用物質の含有量を簡便かつ高精度に測定できる技術の開発へ!~量子化学計算を用いた超精密定量分析手法の確立~
Digital PR Platform / 2024年10月31日 20時5分
ランキング
-
1電気・ガス料金高止まり「風呂キャンセル」「設定温度1℃」で何円変わる? “ちょっとした”節約術をご紹介【Nスタ解説】
TBS NEWS DIG Powered by JNN / 2024年11月29日 21時59分
-
2行列スキップ「ファストパス」飲食店で拡大!食材費や人件費の補填や、ドタキャン対策にも【Nスタ解説】
TBS NEWS DIG Powered by JNN / 2024年11月29日 21時30分
-
3ワークマンは「8800円ランドセル」で勝負…「過去最悪の少子化」でも異業種がランドセル市場に続々参入するワケ
プレジデントオンライン / 2024年11月29日 16時15分
-
4高級タワマン老人ホームへ引っ越しました!…慶應卒・78歳同期の元常務から届いた満面の笑みの年賀状。年金月30万円・元部長は即座に画像検索「脅威の入居金額」に悶絶
THE GOLD ONLINE(ゴールドオンライン) / 2024年11月29日 10時45分
-
5為替相場 30日(日本時間 7時)
共同通信 / 2024年11月30日 7時0分
複数ページをまたぐ記事です
記事の最終ページでミッション達成してください