“スナップショット”解析によって核内構造体が形成されるメカニズムが明らかに
Digital PR Platform / 2024年9月19日 14時0分
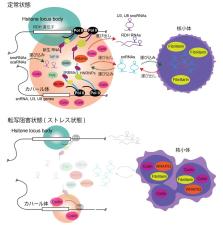
抗体を用いたin situビオチン標識法による核内構造体のマルチオミクス解析
横浜市立大学大学院医学研究科 分子生物学の野口慶介さん(博士課程4年)、鈴木秀文講師、阿部竜太共同研究員、高橋秀尚教授の研究グループは、東京工業大学生命理工学院生命理工学系の山口雄輝教授と共同して、抗体を用いたin situビオチン標識法*1を確立し、細胞の核内のさまざまな構造体について “スナップショットを撮る” ように構成因子を解析することを可能にしました。実際にこの技術を用いて、核内構造体の1つであるカハール体(Cajal body)*2について詳細な解析を行い、カハール体で転写された新生RNA鎖とRNA結合タンパク質との相互作用が、カハール体の形成に重要な役割を果たしている可能性を明らかにしました(図1)。
本研究成果は、米科学誌「Cell Reports」に掲載されました(2024年9月15日オンライン公開)。
研究成果のポイント
抗体を用いたin situビオチン標識法を確立し、核内構造体の構成因子を網羅的に同定することが可能になった。
リン酸化のような翻訳後修飾を見分けて、近傍をビオチン化標識することが可能。
カハール体の潜在的な構成因子が網羅的に同定され、カハール体形成の分子機構の一端が明らかになった。
[画像1]https://digitalpr.jp/simg/1706/95164/250_294_2024091811232066ea39983df85.jpg
図1. 抗体を用いたin situビオチン標識法が、核内構造体の謎を解き明かす
抗体を用いたin situビオチン標識法により、核内構造体における瞬間的な相互作用を捉えることが可能となった。図は、未知の古代遺跡に見立てた核内空間(カハール体)を、HRP*3を搭載した抗体がスキャンして解析している様子を表現しているイメージイラスト。本手法により、核内構造体における未知の分子間相互作用が明らかになると期待される。
研究背景
近年の研究により、液−液相分離(LLPS)*4によって形成される膜を持たない細胞内コンパートメントが、転写、RNAスプライシング*5、DNA修復など、多くの細胞内機能において重要な役割を果たしていることが明らかになってきました。LLPSによって作られる液滴には、天然変性領域と呼ばれる定まった構造をとらない領域を有するタンパク質が含まれており、これらのタンパク質や核酸(DNA、RNA)との間で弱い相互作用が生じることで、液滴が形成されると考えられています。核内構造体として知られる核小体やカハール体も液滴の性質を有することが知られています。核内構造体を含む液滴の機能を解明するためには、それを構成するタンパク質や核酸を網羅的に同定する必要があり、BioID(Proximity-dependent Biotin Identification)法やAPEX(Engineered Ascorbate Peroxidase)法*6など、これまでに核内構造体の構成因子をビオチン標識して質量分析計で同定する手法がいくつか開発されてきました。BioID法やAPEX法などの近傍ビオチン標識法を用いることで、従来の生化学的手法では解析が困難であった分子間の弱い相互作用を捉えることが可能となりました。しかしこれらの方法は、外来性の融合タンパク質を細胞に発現させる必要があることや、ビオチン標識に一定の時間を要するため、内在性のタンパク質の動的な相互作用の変化を捉えることを苦手としていました。第三の手法として、われわれや他の研究グループは抗体を用いたin situビオチン標識法を開発してきました。この方法では、パラホルムアルデヒドで固定した細胞を試料として、抗体を用いて目的タンパク質の近傍空間をビオチン標識するため、瞬間的な相互作用を捉えることが可能になると期待されていました。
この記事に関連するニュース
-
iPS細胞由来巨核球と血小板が創傷治癒を促進~既存治療の欠点を解消する新規製剤の開発に期待~
PR TIMES / 2024年11月26日 10時0分
-
頭蓋咽頭腫における腫瘍微小環境と免疫ネットワークの分子機序の解明 ~頭蓋咽頭腫の新たな治療法にむけて~
PR TIMES / 2024年11月18日 10時45分
-
神経-肝型ミトコンドリアDNA枯渇症の新規原因遺伝子を特定
PR TIMES / 2024年11月9日 13時40分
-
珪藻光化学系Iフコキサンチンクロロフィル結合タンパク質超複合体の立体構造解析を基盤とするタンパク質間相互作用の解明
PR TIMES / 2024年11月8日 5時45分
-
病原性 CD4 陽性 T 細胞に発現するマイクロRNAがケモカイン受容体の発現を制御し、自己免疫疾患発症に関与
PR TIMES / 2024年11月2日 0時40分
ランキング
-
1ワークマンは「8800円ランドセル」で勝負…「過去最悪の少子化」でも異業種がランドセル市場に続々参入するワケ
プレジデントオンライン / 2024年11月29日 16時15分
-
2電気・ガス料金高止まり「風呂キャンセル」「設定温度1℃」で何円変わる? “ちょっとした”節約術をご紹介【Nスタ解説】
TBS NEWS DIG Powered by JNN / 2024年11月29日 21時59分
-
31億円売れた“宇宙服素材”布団 厚さ「3センチ」で真冬越せる性能 どう開発した?
ITmedia ビジネスオンライン / 2024年11月30日 8時10分
-
4NY円、149円台後半=一時1カ月ぶり高値
時事通信 / 2024年11月30日 7時59分
-
5行列スキップ「ファストパス」飲食店で拡大!食材費や人件費の補填や、ドタキャン対策にも【Nスタ解説】
TBS NEWS DIG Powered by JNN / 2024年11月29日 21時30分
複数ページをまたぐ記事です
記事の最終ページでミッション達成してください