ヒトiPS細胞由来肺前駆細胞の拡大培養とマウス肺への移植・生着に成功
PR TIMES / 2021年7月29日 13時45分
肺再生医療の実現へ大きな一歩
呼吸器疾患領域には、数多くの難治性疾患が存在します。外科的肺移植以外の有効な治療法がないため、細胞治療などの肺再生医療へのニーズが高まっています。ヒトiPS細胞は再生医療において有用なツールですが、これまでヒトiPS細胞由来細胞を肺に移植して肺胞上皮細胞として生着させた論文報告はありませんでした。
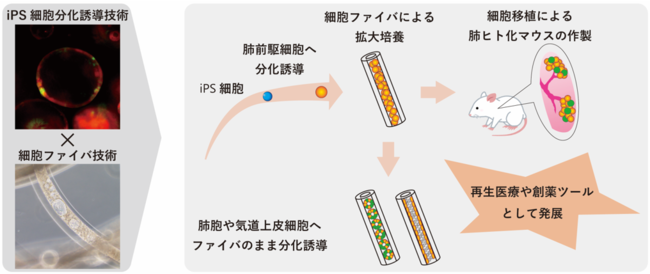
京都大学、HiLung株式会社、株式会セルファイバからなる研究チームは、ヒトiPS細胞から分化させた肺前駆細胞を免疫不全マウスの肺へ移植して長期生着させることに成功しました。さらに、ヒトiPS細胞から分化させた肺前駆細胞を幹細胞の性質を保った状態で拡大培養できることを発見し、その細胞を免疫不全マウスの肺へ移植して生着させることにも成功しました。生着した細胞を解析すると、マウス体内で肺胞をはじめとする様々な呼吸器上皮細胞に分化していることも証明しました。本研究成果はヒトiPS細胞を用いた肺の再生医療に向けた大きな一歩であり、難治性呼吸器疾患の治療法開発に向けて今後が期待されます。
本研究成果は2021年07月20日に国際学術誌「Biomaterials」にオンライン掲載されました。
1.背景
呼吸器疾患領域には、慢性閉塞性肺疾患や肺線維症、急性呼吸窮迫症候群など多くの難治性疾患が存在します。特に、急性呼吸窮迫症候群は極めて予後不良であり、新型コロナウイルス感染症にも合併するため、喫緊の課題とされています。外科的肺移植は呼吸器難治性疾患に対する究極的な治療法ですが、ドナー不足や拒絶反応などさまざまな課題があります。そのため、細胞治療など新たな肺再生医療の開発ニーズが高まっています。これまでに間葉系幹細胞や脂肪由来幹細胞などが細胞治療に用いられてきましたが、パラクライン作用(注1)を目的としたものであり、肺の再建を目的としたものではありませんでした。そして、肺の再建に必要と考えられる肺前駆細胞(注2)は入手だけでなく、培養による増殖や品質維持が困難であったため、再生医療での有用性はこれまで評価されていませんでした。
当研究グループはヒトiPS細胞から分化誘導した肺前駆細胞を用いて培養皿上で肺胞や気道上皮細胞(注3) を効率良く分化誘導する方法を報告してきましたが(参考文献1, 2, 3)、この肺前駆細胞が再生医療に応用可能かどうか、再生医療に十分な数の細胞数が得られるかどうか、という課題が残されていました。また近年、アルギン酸由来のハイドロゲル(注4)マイクロチューブの中に細胞を封入して培養できる技術(細胞ファイバ技術)が開発され、三次元組織構築やスケールアップ培養に適していることが報告されていました(参考文献4, 5)。
[画像1: https://prtimes.jp/i/67783/6/resize/d67783-6-ceb980047a657236f793-0.png ]
2.研究手法・成果
私たちはヒトiPS細胞由来肺前駆細胞を再生医療に応用したいと考えて研究してきました。本研究では主に2つの成果を報告しています。
1. 自己複製能と分化能を有したヒトiPS細胞由来肺前駆細胞の拡大培養に成功(図1)
肺前駆細胞の重要なマーカーとしてNKX2.1(注5)とSOX9(注6)が挙げられます。私たちが報告した従来法で作成された肺前駆細胞(参考文献2)ではNKX2.1の発現を認めますが、SOX9の発現は一部にとどまっていました。本研究では、多能性幹細胞からの分化誘導技術と細胞ファイバ技術を融合することで、ヒトiPS細胞から分化させた肺前駆細胞をファイバ状に拡大培養することに成功しました。この細胞ではNKX2.1の発現に加えて、9割近くの細胞がSOX9を発現していました。加えて、従来法ではマトリゲル(注7)という再生医療に応用することが困難な素材を使用していたのに対し、細胞ファイバ技術を使うとマトリゲルを含まなくても効率よく増殖しました。また、細胞増殖後の肺前駆細胞ファイバについて、分化誘導用の培地に変更するだけで、培養皿上で肺胞や気道上皮細胞へ分化誘導することにも成功しました。興味深いことに、肺の恒常性維持に特に重要な2型肺胞上皮細胞へ、従来法より2倍以上高い効率で分化していることもわかりました。以上より、量と質のいずれの点においても、従来法より優れた肺前駆細胞培養システムを作り上げました。
[画像2: https://prtimes.jp/i/67783/6/resize/d67783-6-58cfc972f50889c78967-1.png ]
図1.左:4週間培養した細胞ファイバ。中:NKX2.1とSOX9を共発現している肺前駆細胞。右:全細胞(赤色発光)のうち半分弱が2型肺胞上皮細胞(緑色発光)へ分化した細胞ファイバ。
2. ヒトiPS細胞由来肺前駆細胞のマウス肺への長期生着に成功(図2)
これまで、ヒトiPS細胞由来細胞をマウス肺に肺胞上皮細胞として生着させた報告はありませんでした。
私たちは小動物用内視鏡を用いた効率的なマウス肺への細胞投与方法を確立し、この方法を用いてナフタレン(注8)と放射線照射による肺障害を起こした免疫不全マウスの肺にヒトiPS細胞由来肺前駆細胞を移植し、2か月間マウス肺の肺胞領域に生着させることに成功しました。また、RNAシークエンス(注9)と蛍光免疫染色の2つの方法で、生着した細胞がマウス生体内で肺胞上皮細胞やクラブ細胞(注10)など様々な呼吸器上皮細胞へ分化していることを確認しました。そして、これまでの培養法による肺前駆細胞の生着に成功したことに加えて、先の1.で拡大培養した肺前駆細胞ファイバからゲルを溶かして細胞を取り出し、マウスへ移植・生着させることにも成功しました。
[画像3: https://prtimes.jp/i/67783/6/resize/d67783-6-91f6e31faccf4f41f882-2.png ]
図2. 左:小動物用内視鏡を用いたマウスへの細胞移植システム。中:HE染色(注11)ではマウスの本来の肺組織と見分けがつきませんが、蛍光免疫染色ではマウス肺に生着したヒト細胞(紫色)を確認できました。移植されたヒトiPS細胞由来肺前駆細胞はマウスの肺と組織的に一体化していることがわかります。右:生着したヒト細胞を取り出してRNAシークエンスを実施し、他の細胞と比較した解析結果。投与したヒトiPS細胞由来の肺前駆細胞が、生着を経てマウス体内で肺胞や気道上皮細胞に近い細胞集団へと変化したことがわかります(右端の遺伝子リストのうち、上段3遺伝子が肺前駆細胞のマーカー、それ以下の遺伝子群が肺胞や気道上皮細胞のマーカーで、黄色くなるほど発現量が多いことを意味します)。
3.波及効果、今後の予定
私たちは本研究で、量と質ともに優れた細胞を得ることができる、マトリゲルを含まない肺前駆細胞の培養システムの構築と、その細胞のマウス肺移植および生着に成功し、ヒトiPS細胞を用いた肺再生医療応用への大きな一歩となりました。生着したヒト由来細胞は既存のマウス肺の細胞と置き換わっており、細胞として機能的に働いていることが期待されます。現在はまだマウス肺の上皮細胞全体の1%程度の置換率ですが、今後はさらに生着効率を高めて、マウス体内でヒトiPS細胞由来のこれらの細胞が正常に機能しているかどうか検討する予定です。引き続き、難治性呼吸器疾患の新たな治療法を確立するべく研究を進めてゆきます。
4.研究プロジェクトについて
本研究は、下記機関より資金的支援を受けて実施されました。
日本医療研究開発機構 再生医療実現拠点ネットワークプログラム、日本学術振興会 特別研究員奨励費・科学研究費補助金、京都大学産学共同実用化促進事業(インキュベーションプログラム)、HiLung株式会社、株式会社セルファイバ
<用語説明>
注1 パラクライン作用:細胞から分泌された物質が周囲の細胞や組織に作用すること。
注2 肺前駆細胞:幹細胞から呼吸器上皮細胞に分化する途中の段階にある細胞のことで、肺胞上皮細胞と気道上皮細胞の両方に分化できる細胞のこと。
注3 肺胞や気道上皮細胞:肺の中の上皮細胞は、空気の通り道となる気道にある気道上皮細胞と、通り道の終着点にある肺胞上皮細胞とに大きく二つにわかれます。肺胞上皮細胞は、1型肺胞上皮細胞という血液とのガス交換を担う細胞と2型肺胞上皮細胞という肺の恒常性を保つ役割を担う細胞にさらにわかれます。
注4 ハイドロゲル:三次元網目状構造をとる高分子の内部に水を含んだ材料。
注5 NKX2.1:NK2 homeobox 1の略。肺の発生初期に発現する転写因子。
注6 SOX9:SRY-box 9の略。肺は、肺芽と呼ばれる突起から先端部が枝分かれして伸長し、気管支や肺胞に分化してゆく。その分化過程で主に遠位端部に発現する転写因子。
注7 マトリゲル:三次元培養で頻用されるゲル状の細胞外基質の一つ。マウス肉腫から成分抽出しており、未知の成分も含まれることから、再生医療への応用は難しいとされる。
注8 ナフタレン:マウスに投与することで、クラブ細胞という気道上皮細胞の一つや肺胞上皮細胞など様々な呼吸器上皮細胞に障害を引き起こす薬剤。
注9 RNAシークエンス:次世代シーケンスを用いることで、遺伝子の発現量が網羅的に解析できる方法。
注10 クラブ細胞:ドーム状の分泌細胞で、気道上皮細胞の一つ。粘液酸性や気道の維持に関与している。
注11 HE染色:ヘマトキシリン・エオシン染色の略。核などを青紫色に、核以外の細胞質や結合組織などを赤色に染めることで組織の構造を染め分ける、代表的な組織染色法。
<研究者のコメント>
マウスの肺胞部分にヒトiPS細胞から分化誘導した細胞が生着するのに試行錯誤を繰り返し、およそ4年の時間を要しました。思うように細胞が生着せず苦しい時もありましたが、この研究成果が将来の医療につながる可能性を信じて、今後の進展を期待できる大事な一歩を進めることができました。支えていただいた全ての方々に感謝申し上げます。引き続き、課題を解決しながら、難治性呼吸器疾患に苦しむ患者さんへ少しでも早く届けられるように努力して参ります。
<参考文献>
1. Gotoh S, et al. (2014). Generation of alveolar epithelial spheroids via isolated progenitor cells from human pluripotent stem cells. Stem Cell Reports, 3(3), 394-403.
2. Yamamoto Y, et al. (2017). Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nat Methods, 14(11), 1097-1106.
3. Konishi S, et al (2016). Directed induction of functional multi-ciliated cells in proximal airway epithelial spheroids from human pluripotent stem cells. Stem Cell Reports, 6(1), 18-25.
4. Onoe H, et al. (2013). Metre-long cell-laden microfibres exhibit tissue morphologies and functions. Nat Materials, 12(6), 584-590.
5. Ikeda K, et al. (2017). Cell fiber-based three-dimensional culture system for highly efficient expansion of human induced pluripotent stem cells. Scientific Reports, 7(1), 2850.
<論文タイトルと著者>
タイトル:
Core-shell hydrogel microfiber-expanded pluripotent stem cell-derived lung progenitors applicable to lung reconstruction in vivo(コアシェル型ハイドロゲルマイクロファイバーを用いた多能性幹細胞由来肺前駆細胞の拡大培養および生体内における肺再構築への応用)
著 者:
Satoshi Ikeo, Yuki Yamamoto, Kazuhiro Ikeda, Naoyuki Sone, Yohei Korogi, Lucia Tomiyama, Hisako Matsumoto, Toyohiro Hirai, Masatoshi Hagiwara, Shimpei Gotoh
掲載誌:Biomaterials
DOI:10.1016/j.biomaterials.2021.121031
企業プレスリリース詳細へ
PR TIMESトップへ
この記事に関連するニュース
-
生体に近いヒトiPS細胞由来小腸上皮細胞モデルで、ブルガリア菌とサーモフィラス菌による腸管バリア機能強化を確認
共同通信PRワイヤー / 2024年4月24日 14時0分
-
「R-1 EPS」がインフルエンザウイルス感染による病原体の侵入を防ぐ肺上皮バリア機能の損傷を抑制
共同通信PRワイヤー / 2024年4月23日 14時0分
-
組換え植物細胞を自発的に分化させる技術の開発 ー細胞・組織培養の省力化に貢献ー
PR TIMES / 2024年4月17日 16時45分
-
東北大、従来の1/10のコストで済むマウス肺とヒト細胞の臓器移植実験に成功
マイナビニュース / 2024年4月9日 15時14分
-
新変異株の高病原性予測へ新技術、iPS細胞で実験用肺胞や気道の上皮作製 京都大学研究所など発表
京都新聞 / 2024年3月29日 0時0分
ランキング
-
1なぜ歯磨き粉はミント味? ヒット商品の誕生には「無駄」が必要なワケ
ITmedia ビジネスオンライン / 2024年4月26日 8時0分
-
2突然現場に現れて「良案」を言い出す上司の弊害 「気になったら即座に直したい」欲求への抗い方
東洋経済オンライン / 2024年4月26日 8時0分
-
3濃口醤油と淡口醤油、塩分が高いのはどっち?…醤油の「色の濃さ」と「味の濃さ」の知られざる関係
プレジデントオンライン / 2024年4月26日 8時15分
-
4「加賀屋」50歳の元若女将が選んだ"第2の人生" 震災からの復興への道、仕事術について聞く
東洋経済オンライン / 2024年4月26日 12時0分
-
5円安、物価上昇通じて賃金に波及するリスクに警戒感=植田日銀総裁
ロイター / 2024年4月26日 18時5分
記事ミッション中・・・
記事にリアクションする
![]()
記事ミッション中・・・
記事にリアクションする

エラーが発生しました
ページを再読み込みして
ください










