新型コロナウイルス臨床分離株からレムデシビル耐性と細胞融合性を確認
PR TIMES / 2024年5月1日 15時45分
免疫抑制状態の患者から長期に排出されたウイルス遺伝子の変異を分析
[画像1: https://prcdn.freetls.fastly.net/release_image/15177/851/15177-851-336a6c4819a8a95d0d966fcc2538a529-823x301.png?width=536&quality=85%2C75&format=jpeg&auto=webp&fit=bounds&bg-color=fff ]
多様でダイナミックな遺伝子変異の結果、レムデシビル耐性アミノ酸変異C799Fに置き換わった
千葉大学医学部附属病院(病院長 大鳥精司)感染制御部の猪狩英俊部長らの研究グループは、新型コロナウイルス臨床分離株(オミクロン株BA.5)からレムデシビル耐性となる変異を含めて、遺伝子が大幅に多様性を示し、またウイルスの性質も変化(細胞融合性の増加)した症例を確認しました。
なお、本研究成果は2024年4月29日、Nature Communications誌に掲載されました。
【本研究の概要】
SARS-CoV-2に感染し、中等度以上の症状を示した場合、一般的な治療法として、免疫を制御する薬剤のほか、抗ウイルス薬であるレムデシビル(ウイルスが持つRNAゲノムを複製する際に働くRNA依存性RNAポリメラーゼという酵素に作用する阻害剤)を投与してウイルス増殖を抑制することが標準化されています。
今回報告の症例(臓器移植患者で、オミクロンBA.5株に感染)では、標準化された治療を受け、一旦は軽快して退院しましたが、10日後に再び症状が悪化、再入院となりました。
ウイルスの遺伝子配列を調べたところ、RNAポリメラーゼをコードするnsp12と呼ばれる遺伝子領域にいくつかのアミノ酸変異を確認しました。特に、注目すべきはC799F(ポリメラーゼ蛋白質の799番目のアミノ酸が本来であればシステイン残基(C)であるところ、フェニルアラニン(F)に置き換わった)変異は、レムデシビル耐性をもたらすことにより、治療が困難になり、持続的なウイルスが排出されるようになります。
さらに、くわしく調べた結果、レムデシビルに対する耐性を獲得したことに加え、スパイク蛋白質領域を中心に遺伝子全体が大幅に変異したこと(元の株から最大16箇所アミノ酸が変異)、そして最終的にウイルス自体の性質も変化(細胞融合能の獲得)していることが明らかになりました。
感染した細胞同士が互いに融合接着して大きな細胞塊(細胞のかたまり)となる、いわゆる細胞融合能は、デルタ株の場合には強い病原性と関連することが指摘されています。オミクロン株は、このような性質を持たないと言われていましたので、今回の現象は注目に値します。
【感染制御部 猪狩英俊部長のコメント】
一人の患者さんの身体の中でこれだけの変化を詳細に解析した例は、私が知る限り初めてとなります。本研究により、免疫不全患者の治療では、従来のレムデシビル単剤療法では期待した効果を示さない場合があり、注意を要することが明らかとなりました。そうしたことを今後防ぐためには、新たな薬の開発の必要性と共に既存の薬剤をうまく組み合わせた併用療法の確立などが求められていると考えています。
【論文骨子の解説】
1. 多様でダイナミックなウイルスの遺伝子変異
(ア) 2回目のレムデシビル治療直後よりマイナー変異が出現し、最大64変異を確認した。
(イ) 3回目のレムデシビル治療後も最大37のマイナー変異を確認した。
(ウ) 初回治療でいったん軽快するも再び増悪し、レムデシビル(RDV)の2回目治療を目的に再入院した。この時点でメジャー変異は54(2019年12月に確認された株との比較)あった。しかし、RDVの治療効果は不十分で、最大70変異に増加した。
(エ) マイナー変異が先行して現れた後、大半は消失するものの、メジャー変異に移行するものがあった。
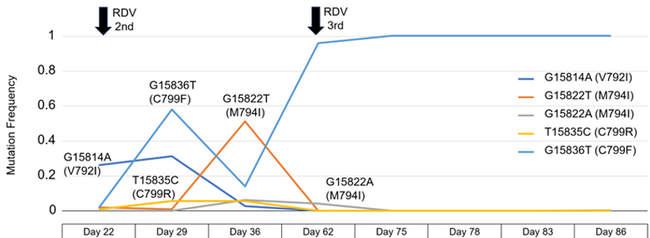
(オ) RdRp(RNA依存性RNAポリメラーゼ)領域で認められた変異 (レムデシビル耐性に関連)
1. V792I, M794Iはそれぞれマイナー、メジャー変異として出現し、すぐに消失した。
2. C799Fは存在頻度58%のメジャー変異として出現し、いったんはマイナー変異となるが、その後メジャー変異として定着した。
[画像2: https://prcdn.freetls.fastly.net/release_image/15177/851/15177-851-0f208f3c12f852b6aa977580051576a0-823x301.png?width=536&quality=85%2C75&format=jpeg&auto=webp&fit=bounds&bg-color=fff ]
多様でダイナミックな遺伝子変異の結果、レムデシビル耐性アミノ酸変異C799Fに置き換わった
2. 細胞融合性
(ア) 当初分離された株は通常のオミクロン株と同様に細胞融合能はなかった。
(イ) Day62とそれ以降に分離された株では細胞融合能を獲得した。
[画像3: https://prcdn.freetls.fastly.net/release_image/15177/851/15177-851-f89978693b98933d06eb2d952aa25d57-658x419.png?width=536&quality=85%2C75&format=jpeg&auto=webp&fit=bounds&bg-color=fff ]
[画像4: https://prcdn.freetls.fastly.net/release_image/15177/851/15177-851-42571d8ba726c2bfad5b1d23732c56f7-657x419.png?width=536&quality=85%2C75&format=jpeg&auto=webp&fit=bounds&bg-color=fff ]
3. RDV耐性
(ア) 最初に分離した株はRDVに対してEC50=0.8µMであったが、C799Fを有するウイルス株ではEC50=2.7µMであった。
[画像5: https://prcdn.freetls.fastly.net/release_image/15177/851/15177-851-d02457f150c0b3475167b443d41b0f17-296x255.png?width=536&quality=85%2C75&format=jpeg&auto=webp&fit=bounds&bg-color=fff ]
4. 3次元構造解析
RdRpのアミノ酸の側鎖とレムデシビルの間には、疎水性の相互作用が示された。変異株の場合、レムデシビルは作用部位であるRdRpに到達し難くなり、その結果抗ウイルス効果が減弱すると考えられた。
[画像6: https://prcdn.freetls.fastly.net/release_image/15177/851/15177-851-5a1f2527d0bbdb35dbbb96837792d5b0-1306x576.png?width=536&quality=85%2C75&format=jpeg&auto=webp&fit=bounds&bg-color=fff ]
[画像7: https://prcdn.freetls.fastly.net/release_image/15177/851/15177-851-ec04948099ddbe2db194ade6156e6980-1328x512.png?width=536&quality=85%2C75&format=jpeg&auto=webp&fit=bounds&bg-color=fff ]
◆ 論文タイトル
ジャーナル Nature Communications
タイトル Dynamic diversity of SARS-CoV-2 genetic mutations in a lung
transplantation patient with persistent COVID-19
和文 臓器移植後に新型コロナウイルスに感染し慢性持続感染状態になった患者に起こった、新型コロナウイルスのダイナミックで多様な遺伝子変異に関する研究
◆著者
猪狩英俊1,2,3,4、坂尾誠一郎5,6、石毛崇之7、齋藤謙悟8、村田正太7、矢幅美鈴1、谷口俊文1,4、菅波晃子9、松下一之7、田村裕9、鈴木拓児2,5,10、井戸栄治1,8
1 千葉大学医学部附属病院 感染制御部
2 千葉大学医学部附属病院 未来粘膜ワクチン研究開発センター
3 千葉大学医学部附属病院 新型コロナワクチンセンター
4 千葉大学災害治療学研究所
5 千葉大学大学院医学研究院 呼吸器内科学
6 国際医療福祉大学医学部 呼吸器内科学
7 千葉大学医学部附属病院 検査部
8 千葉大学大学院医学研究院 分子ウイルス学
9 千葉大学大学院医学研究院 生命情報科学
10 千葉大学未来粘膜ワクチン研究開発シナジー拠点(cSINVa)
Hidetoshi Igari 1,2,3,4, Seiichiro Sakao 5,6, Takayuki Ishige 7, Kengo Saito 8, Shota Murata 7, Misuzu Yahaba 1, Toshibumi Taniguchi 1,4, Akiko Suganami 9, Kazuyuki Matsushita 7, Yutaka Tamura 9, Takuji Suzuki 2, 5,10, Eiji Ido 1,8
1 Department of Infectious Diseases, Chiba University Hospital, Chiba City, Chiba, Japan
2 Future Mucosal Vaccine Research and Development Center, Chiba University Hospital, Chiba City, Chiba, Japan
3 COVID-19 Vaccine Center, Chiba University Hospital, Chiba City, Chiba, Japan
4 Research Institute of Disaster Medicine, Chiba University, Chiba City, Chiba, Japan
5 Department of Respiratory Medicine, Chiba University Hospital, Chiba City, Chiba, Japan
6 Department of Pulmonary Medicine, School of Medicine, International University of Health and Welfare, Narita City,
Chiba, Japan
7 Division of Laboratory Medicine, Chiba University Hospital, Chiba City, Chiba, Japan
8 Department of Molecular Virology, Graduate School of Medicine, Chiba University, Chiba City, Chiba, Japan
9 Department of Bioinformatics, Graduate School of Medicine, Chiba University, Chiba City, Chiba, Japan
10 Synergy Institute for Futuristic Mucosal Vaccine Research and Development, Chiba University, Chiba City, Chiba, Japan
◆研究助成
千葉大学 未来粘膜ワクチン研究開発シナジー拠点(cSIMVa)
国立研究開発法人日本医療研究開発機構 (AMED) (JP223fa627003).
企業プレスリリース詳細へ
PR TIMESトップへ
この記事に関連するニュース
-
女性ホルモンが胎盤で作られる仕組みを解明
Digital PR Platform / 2024年5月14日 17時24分
-
データサイエンスの活用により皮膚老化に対し効果的な因子がトロンボスポンジン-1(THBS1)※1であることが判明
PR TIMES / 2024年5月10日 17時40分
-
【5/10開催】千葉大学真菌医学研究センター市民向け公開セミナーを開催 身の回りの菌や病気の話題について専門家が解説
PR TIMES / 2024年4月22日 11時15分
-
武蔵野大など、水虫の薬剤耐性菌に胃酸抑制薬が有効なことを発見
マイナビニュース / 2024年4月18日 6時30分
-
組換え植物細胞を自発的に分化させる技術の開発 ー細胞・組織培養の省力化に貢献ー
PR TIMES / 2024年4月17日 16時45分
ランキング
-
1なぜマックで“客への反撃”が増えているのか いまだ続ける「スマイル0円」との関係
ITmedia ビジネスオンライン / 2024年5月15日 7時16分
-
2東大入試で出題「じゃんけんグリコ」必勝法の衝撃 「小学校の算数」で解ける問題を東大が出す意味
東洋経済オンライン / 2024年5月15日 9時20分
-
3予約3年待ち「とだか」も入る五反田新ビルの正体 ゆうぽうと跡地に再開発、星野リゾートも参画
東洋経済オンライン / 2024年5月15日 11時20分
-
4【速報】スマホ決済「PayPay」決済や送金などのサービス復旧
TBS NEWS DIG Powered by JNN / 2024年5月15日 16時17分
-
5ガソリン174円50銭 2週ぶり値下がり
共同通信 / 2024年5月15日 15時30分
記事ミッション中・・・
記事にリアクションする
![]()
記事ミッション中・・・
記事にリアクションする

エラーが発生しました
ページを再読み込みして
ください










